
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A. 等质量的NaHCO3和Na2CO3与足量的盐酸反应,产生CO2的质量:Na2CO3多
B. 等质量的NaHCO3和Na2CO3与盐酸反应,产生CO2的速率:NaHCO3快
C. CaCl2溶液加入到NaHCO3溶液中不产生沉淀,加入到Na2CO3溶液中产生白色沉淀
D. 除去Na2CO3固体中混有的少量NaHCO3的最好方法是加热
【答案】A
【解析】
A、碳酸氢钠中碳的质量分数高于碳酸钠,等质量的碳酸钠和碳酸氢钠分别与过量盐酸反应,碳元素全部转化成CO2,所以碳酸氢钠放出的CO2多,故A错误;
B、Na2CO3与盐酸反应需经过:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,而NaHCO3可直接与HCl反应生成气体,故等质量的NaHCO3和Na2CO3与盐酸反应,产生CO2的速率:NaHCO3快,故B正确;
C、CaCl2溶液加入到NaHCO3溶液中不反应,不产生沉淀,而CaCl2溶液加入到Na2CO3溶液中反应产生CaCO3白色沉淀,故C正确;
D、加热时Na2CO3不分解,NaHCO3受热分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,不会引入杂质,故D正确;答案为A。
Na2CO3+CO2↑+H2O,不会引入杂质,故D正确;答案为A。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。W、D、E三种元素的简单离子的离子半径由大到小顺序为______________(用离子符号表示)
(2)由A、B、W三种元素组成的18电子微粒的电子式为_____________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,该反应的化学方程式为______________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是
A.Mc的最低负化合价为-3B.Mc的最高价氧化物的化式为Mc2O 5
C.![]() 的中子数为115D.通过化学反应可使
的中子数为115D.通过化学反应可使![]() 转化为
转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学在实验室模拟用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝 [A12(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究,相关过程如下:
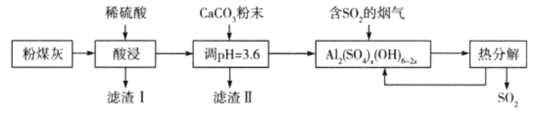
下列说法错误的是
A.滤渣I、II的主要成分分别为SiO2、CaSO4
B.若将pH调为4,则可能导致溶液中铝元素的含量降低
C.吸收烟气后的溶液中含有的离子多于5种
D.完全热分解放出的SO2量等于吸收的SO2量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应A(g)+B(g)![]() 2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①单位时间内消耗amolA,同时生成2amolC
②混合气体的总压强不再变化
③混合气体的密度不再变化
④A、B、C的分子数之比为1∶1∶2
⑤反应容器中温度不变
⑥A的转化率与B的转化率相等时
A. ①②④⑥ B. ②④⑥ C. ①④⑥ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金广泛应用于国防生产中。
(1)工业上是通过电解熔融状态![]() 的方法冶炼金属镁的,则
的方法冶炼金属镁的,则![]() 的电子式为___;工业上不用电解熔融MgO来冶炼镁的原因是_____。
的电子式为___;工业上不用电解熔融MgO来冶炼镁的原因是_____。
(2)氢化镁是一种危险化学品。遇湿易燃,其原因是____。
(3)高纯度氧化镁在医药,建筑行业有着广泛的应用,硫酸镁还原热解制备高纯氧化镁是一种新生产工艺,以菱镁矿(主要成分为![]() ,含少量
,含少量![]() )为原料,制备高纯氧化镁的流程如图(已知
)为原料,制备高纯氧化镁的流程如图(已知![]() 、
、![]() ):
):
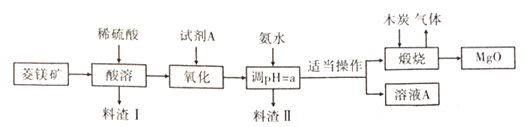
①酸浸前对矿石进行粉碎的好处是____。试剂A是一种绿色氧化剂。常温下为液态,写出“氧化”过程中发生反应的离子方程式_____。
②为除尽杂质,a的取值应不小于___(当杂质离子浓度小于![]() 时,可认为已除尽;
时,可认为已除尽;![]() ≈0.2)。
≈0.2)。
③煅烧过程中可发生多个反应。试写出氧化剂与还原剂按物质的量为2:1的比例恰好反应时的化学方程式_____,反应生成的气体均为____(填“酸性”或“碱性”)氧化物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、R、W、G在周期表中的相对位置如图所示。下列说法正确的是
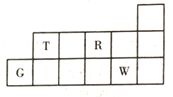
A.T的氢化物的沸点一定低于R的
B.W的氧化物对应的水化物一定是强酸
C.T和W组成的化合物含两种化学键
D.工业上电解熔融氧化物制备G的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化钛制金属钛,主要反应有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2![]() TiCl4↑+CO↑
TiCl4↑+CO↑
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是( )
A. 反应①属于非氧化还原反应
B. 反应②是水解反应
C. 反应④中二氧化钛是氧化剂
D. 反应⑤表现了金属镁还原性比金属钛强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
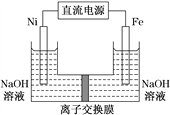
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com