
��18����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g)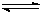 CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��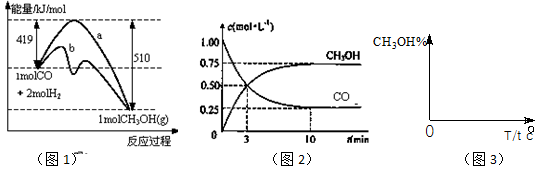
��ش��������⣺
��1���ڡ�ͼ1���У����� ���a��b����ʾʹ���˴������÷�Ӧ���� ������ȡ����ȣ���Ӧ��
��2������˵����ȷ����
A����ʼ�����COΪ2mol
B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬
D�������¶Ⱥ��ܱ������ݻ��� �䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ
�䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ
n(CH3OH)/n(CO)���С
��3���� ��Ӧ��ʼ������ƽ�⣬ v(H2)=________����֪����һ���¶��£���һ�����淴Ӧ�ﵽ��ѧƽ��ʱ��������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��һ������������������Ǹ÷�Ӧ�Ļ�ѧƽ�ⳣ������ô�ڸ��¶���CO(g)+2H2(g)
��Ӧ��ʼ������ƽ�⣬ v(H2)=________����֪����һ���¶��£���һ�����淴Ӧ�ﵽ��ѧƽ��ʱ��������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��һ������������������Ǹ÷�Ӧ�Ļ�ѧƽ�ⳣ������ô�ڸ��¶���CO(g)+2H2(g) 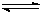 CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ_______________�������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____
CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ_______________�������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____ �����������С�����䡱����
�����������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1<P2����
(5) ��һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ��H����49.0kJ/mol
B��CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g) ��H����192.9kJ/mol
��֪H2O(l)= H2O(g) ��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��
 ���ſ����ϵ�д�
���ſ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���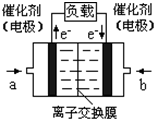 ��ͼ����a��ͨ�����
��ͼ����a��ͨ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����ĸ���������ģ�⿼�ԣ������ۺϣ���ѧ���� ���ͣ������
��15�֣�2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�顣����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
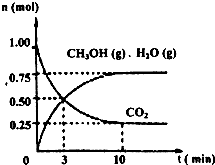
��1��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2L���ܱ������У�����1mol CO2��3��25mol H2����һ�������·�����Ӧ�����CO2��CH3OH��g����H2O��g�������ʵ�����n����ʱ��仯����ͼ��ʾ��
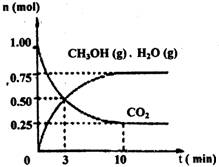
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= ��
�����д�ʩ��һ������ʹn��CH3OH��/n��CO2��������ǣ� ��
A�������¶� B����С�������ݻ�
C����ˮ��������ϵ�з��� D��ʹ�ø���Ч�Ĵ���
��2�����³�ѹ�£�����CO 2ˮ��Һ��pH =5��6��c��H2CO3��=1��5 ��l0-5
mol��L-1���� ����ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3 HCO3- +H+�ĵ���ƽ�ⳣ��K= ������֪��10 -5��6=2��5��l0-6����
HCO3- +H+�ĵ���ƽ�ⳣ��K= ������֪��10 -5��6=2��5��l0-6����
��3����״���£���1��12LCO2ͨ��100mL 1mol��L-1��NaOH��Һ�У�������Һ������Ũ���ɴ�С��˳��Ϊ ��
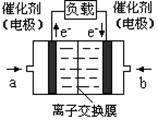
��4����ͼ���Ҵ�ȼ�ϵ�أ��������ҺΪKOH��Һ���Ľṹʾ��ͼ����a��ͨ����� ����Ҵ���������������b���缫�Ϸ����ĵ缫��Ӧ�ǣ� ��
��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2��8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ��ӱ�ʡ��ˮ��ѧ�������ϣ�������ѧ�Ծ��������棩 ���ͣ������
| ��ѧ�� | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| ����/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
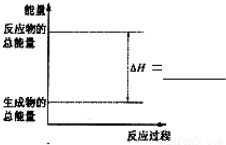
 Si��s��+4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=______
Si��s��+4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=______| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2-t1�� /�� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com