
【题目】下列有关化学键的类型说法正确的是( )
A. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B. 非金属元素组成的化合物中只含共价键
C. H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物
D. NaHCO3和HCOONa都只含离子键
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.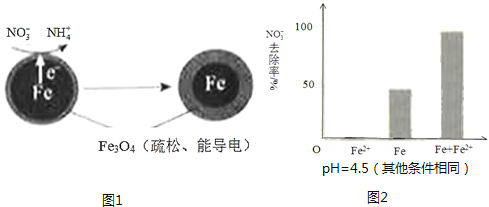
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下: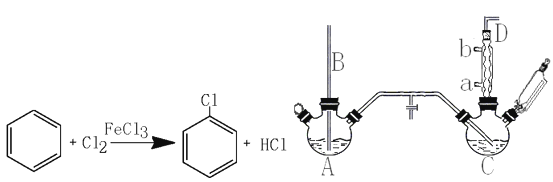
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是。冷凝管中冷水应从(填“a”或“b”)处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯。
①对C加热的方法是(填序号)。
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、和。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:;(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则1t苯可制得成品为t(只要求列式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( ) 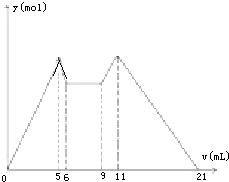
A.A是盐酸,B是NaOH,且C(NaOH)=2C(HCl)
B.原混合液中,C(Al3+):C(Mg2+):C(Cl﹣)=1:1:5
C.A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1
D.从6到9,相应离子反应式H++OH﹣═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下如图物质一步转化关系的选项是( )
X | Y | Z | |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)合成氨的工业设备名称是 , 设备中设置热交换器的目的是;此生产过程中,N2与H2合成NH3所用的催化剂是;生产中原料气必须进行脱硫,目的是。
(2)吸收塔中的反应为 , 从生产流程看,吸收塔中需要补充空气,其原因是。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是 , 缺点是。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的%(保留三位有效数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去). A ![]() B
B ![]() C
C ![]() D
D
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体. ①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境.
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 , 用化学方程式表示该物质与水的反应 . 将C长期露置于空气中,最后将变成物质D,D的化学式为 . 现在有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为 .
(3)若C是红棕色气体.图是实验室制取A气体的装置: 
①写出实验室制取A的化学方程式 .
②为了检验氨气是否集满,可将 , 则证明已收集满.D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表(律)说法正确的是
A. 最外层有两个电子的原子一定在ⅡA 族
B. IA族均为碱金属
C. 同一周期核电荷数越大原子半径越大
D. 同一主族核电荷数越大元素金属性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com