
【题目】美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法不正确的是( ) 
A.CO2属于酸性氧化物
B.CO与O形成化学键的过程中放出能量
C.钌催化剂可以改变该反应的焓变
D.CO与O形成化学键的过程中有电子转移
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】25℃,pH=2的 HC1溶液中,由水电离出的c(H+)是( )
A.1×10﹣7 mol/L
B.1×10﹣12mol/L
C.1×10﹣2 mol/L
D.1×10﹣7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组中的每种有机物分别放入水中,振荡后再静置,液体分层且该组的全部物质都能浮在水的上层的是( )
A.1﹣己炔、甲苯、十一烷
B.乙醇、苯、溴苯
C.乙二醇、乙醛、硝基苯
D.溴苯、四氯化碳、乙酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D四种强电解质溶液,分别含有下列阴阳离子中的各一种,且互不重复:Ba2+、H+、Na+、NH4+、CO32﹣、NO3﹣、SO42﹣、OH﹣ . 已知:①A和B反应生成的气体能被D吸收,而A和D反应生成的气体能被B吸收;②向A或D中滴入C,均有白色沉淀产生.另有晶体E的摩尔质量为474g/mol,可用于自来水的净水剂.试判断:
(1)晶体E的名称为 , 用离子方程式和必要的文字说明E可用作净水剂的原理 .
(2)写出A、B、C的化学式:A , B , C .
(3)写出A与D反应的离子方程式 .
(4)将200mL0.5mol/L的B溶液加入到150mL0.2mol/L的E溶液中,最终生成的白色沉淀质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4FeSO46H2O]比绿矾(FeSO47H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下: 废铁屑 ![]()
![]() 溶液A
溶液A ![]()
![]()
![]() 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是; 证明溶液A不含Fe3+离子的最佳试剂是(填序号字母).
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、、过滤.
(2)将莫尔盐晶体放在托盘天平左盘进行称量时,天平指针向右偏转,说明 .
(3)为了测定所得莫尔盐中Fe2+的含量,称取4.0g莫尔盐样品,溶于水配成溶液并加入稀硫酸,用0.2mol/L的KMnO4溶液进行滴定,到滴定终点时,消耗了KMnO4溶液10.00mL.则样品中Fe2+的质量分数为(已知反应中MnO4﹣变为Mn2+).
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接;接 . 将装置C中两种液体分离开的操作名称是 . 装置D的作用是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2( g )+O2( g )=2H2O ( l );△H=﹣572kJ/mol
②2H2( g )+O2( g )=2H2O ( g );△H=﹣484kJ/mol
③CH4 ( g )+2O2( g )=2H2O ( l )+CO2( g );△H=﹣890kJ/mol
(1)已知H﹣H的键能436kJ/mol O=O的键能496kJ/mol H﹣O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出 . 并计算写出反应 H2O ( l )=H2O ( g )的焓变△H= .
(2)请根据题干计算CO2(g)+4H2( g )=CH4( g )+2H2O( g )的焓变△H= .
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式 . (填反应方程式的序号)
标准状况下,取甲烷和氢气的混合气体11.2L完全燃烧后恢复到常温,则放出的热量为26、3.8kJ,试求混合气体中甲烷和氢气体积比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
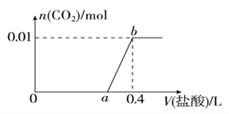
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的下列叙述中错误的是( )
①等质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2多
②84 g NaHCO3、106 g Na2CO3分别与足量的盐酸完全反应,Na2CO3消耗盐酸的物质的量是NaHCO3的两倍
③将澄清石灰水分别倒入两种盐溶液中,只有Na2CO3溶液中产生白色沉淀
④通常状况下,相同温度下,Na2CO3的溶解度大于NaHCO3
A. ①② B. ②③ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下: 已知:NO2+NO+2NaOH═2NaNO2+2H2O,2NO2+2NaOH═2NaNO2+H2O.
回答下列问题:
(1)步骤①水解液中所含主要有机物为(写结构简式),浸取时要想提高水解速率除可减小甘蔗碎渣粒度外,还可采取的措施是;浸取时硫酸浓度不宜过高,其原因是 .
(2)步骤②会生成草酸,硝酸的还原产物为NO2和NO且n(NO2):n(NO)=3:1,则反应的离子方程式为 , 生成的NO2及NO若被NaOH溶液完全吸收,则产物中的两种盐n(NaNO2):n(NaNO3)= .
(3)步骤③的主要目的是 .
(4)设计步骤⑦和⑧的目的分别是、 .
(5)为了确定产品中H2C2O42H2O的纯度,称取10.5g草酸样品,配成250mL溶液,每次实验时准确量取20.00mL草酸溶液,加入适量的稀硫酸,用0.10molL﹣1的KMO4标准溶液滴定.平行滴定三次,消耗KMO4标准溶液的体积平均为26.00mL.则产品中H2C2O42H2O的质量分数为 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com