
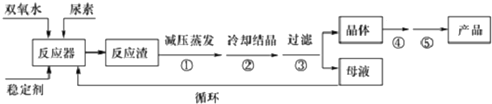
���� �Ʊ�������̼�����������̣���Ӧ�������ù�����������ػ��Ϸ�Ӧ���ɹ�����̼��������Ӧ�Ļ�ѧ����ʽΪ��CO��NH2��2+H2O2=CO��NH2��2•H2O2����Ӧ����ټ�ѹ���������ͷе㣬��ֹ���������¹�����̼�����ֽ⣬����ȴ�ᾧ�����۹��˵õ�CO��NH2��2•H2O2�ֲ�Ʒ��ϴ�Ӹ���õ�������̼�������壬ĸҺ������õ����غ�Ư����Ư����Ҫ���й������⣬���Դ�ĸҺ��ѭ�����õ�����Ϊ���غ������⣮
��1��ˮԡ���ŵ���ʹ�����������Ⱦ��ȣ��������ڿ��Ƽ����¶ȣ�CO��NH2��2•H2O2���Ʊ��¶Ƚϵͣ��¶Ƚϸ��ֽ⣬Ӧ����ˮԡ���ȣ�ĸҺ������õ����غ�Ư����
��2��������̼�����ֽ⣬�Ը��¶�ʱ����45�棩���ֽ⣻���۹��˵õ�CO��NH2��2•H2O2�ֲ�Ʒ�������ܡ�������Ϊϴ�ӡ�����õ�������̼�������壻
��3��ʪ�����ղ������̸��ӣ��ɷ��������̶̣����ɷ����ղ�Ʒ�ȶ��Բ�豸���ӣ�
��4���ٸ���������ԭ��Ӧ�У����ϼ����ߵļ����ͽ�����ȣ�MnO4?��MnԪ�ؽ���5�ۣ�H2O2��OԪ������1�ۣ�����MnO4?��Mn2+��ϵ��Ϊ2��H2O2��O2��ϵ��Ϊ5��Ȼ�����ù۲취��ƽ��ѧ����ʽ��
����֪������KMnO4��Һ����Ӧ�������ķ�ӦΪ2MnO4-+5H2O2+6H+�T2Mn2++8H2O+5O2�������ݸ�����ص����ʵ������H2O2��CO��NH2��2•H2O2�����ʵ��������������������������
��� �⣺��1��CO��NH2��2•H2O2���Ʊ��¶Ƚϵͣ�CO��NH2��2•H2O2��45��ʱ�����ֽ⣬���Բ����þƾ���ֱ�Ӽ��ȣ�Ӧ����ˮԡ���ȣ�ĸҺ����ѭ��ʹ�����ԭ�������ʣ�ĸҺ�к���H2O2�����أ���ѹ�������õ�H2O2��Ȼ��ᾧ�õ����أ����Դ�ĸҺ��ѭ�����õ�����ΪCO��NH2��2��H2O2��
�ʴ�Ϊ��ˮԡ���ȣ�CO��NH2��2��H2O2��
��2��������̼�������¶ȸ���45��ʱ�ᷢ���ֽ⣬���ü�ѹ����ʱ��Һ���ڽϵ��¶��¼��ɻӷ������Է�ֹ������̼���������ֽ⣻��Ӧ����ټ�ѹ���������ͷе㣬��ֹ���������¹�����̼�����ֽ⣬����ȴ�ᾧ�����۹��˵õ�CO��NH2��2•H2O2�ֲ�Ʒ��ϴ�Ӹ���õ�������̼�������壬
�ʴ�Ϊ�����ͷе㣬��ֹ���������¹�����̼�����ֽ⣻ ϴ�ӣ����
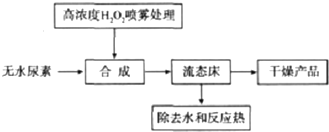
��3���ɷ����������ʪ�����ղ������̶̣����ռ����ɷ���������̬�����豸���豸���ӣ����Ũ�ȵĹ����������������������������̣������Ʒ�ֽ⣬��Ʒ�ȶ��Բ��Ʒ��Ⱦ�����ȣ�
�ʴ�Ϊ�����̶̣����ռ�˫��ˮŨ�ȸ߾���Ч��͡��豸���ӡ������������̡���Ʒ�ȶ��Բ��Ʒ��Ⱦ�����ȣ�
��4���ٸ���������ԭ��Ӧ�У����ϼ����ߵļ����ͽ�����ȣ�MnO4?��MnԪ�ؽ���5�ۣ�H2O2��OԪ������1�ۣ�����MnO4?��Mn2+��ϵ��Ϊ2��H2O2��O2��ϵ��Ϊ5��Ȼ�����ù۲취��ƽ��ѧ����ʽΪ��2MnO4-+5H2O2+6H+�T2Mn2++8H2O+5O2����
�ʴ�Ϊ��2��5��6�� 2��8�� 5O2��
��������KMnO4��Һ����Ӧ��������̼������KMnO4����Һ�����ķ�ӦΪ��5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2�������ӷ�ӦΪ��2MnO4-+5H2O2+6H+�T2Mn2++8H2O+5O2����
5H2O2����������2KMnO4
5 2
nmol 0.2500mol•L-1��0.040L
��n=0.025mol������CO��NH2��2•H2O2Ϊ0.025mol��������Ϊ0.025mol��94g/mol=2.35g
���Բ�Ʒ��CO��NH2��2•H2O2����������Ϊ$\frac{2.35g}{3g}$��100%��78.3%��
�ʴ�Ϊ��78.3%��
���� ���⿼���˹�����̼�������Ʊ�ʵ����̷����жϣ�Ϊ��Ƶ���㣬���շ����Ļ�ѧ��Ӧ��ʵ�����Ϊ���Ĺؼ������ط���������ʵ�������Ŀ��飬ע����Ϣ����ѧ֪ʶ�Ľ�ϣ���Ŀ�Ѷ��еȣ�


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
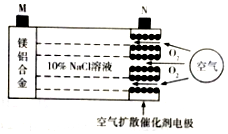 �п�Ժ�����������з�����������ػ���ش�ͻ�ƣ��õ�صĹ���ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ�������
�п�Ժ�����������з�����������ػ���ش�ͻ�ƣ��õ�صĹ���ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | ��ع���ʱ������������Һ��pH���� | |
| B�� | ��ع���ʱ��������M�������·����N�� | |
| C�� | ��·��ת��2mol���ӣ�������Լ���ı�״���¿���56L | |
| D�� | ����ܷ�ӦΪ4Al+3O2=2Al2O3��2Mg+O2=2MgO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼����������CaCO3+2H+�TCa2++H2O+CO2�� | |
| B�� | ��Ͷ��ˮ�У�Na+H2O�TNa++2OH-+H2�� | |
| C�� | ���ۼ���ϡ�����У�2Fe+6H+�T2Fe3++3H2�� | |
| D�� | ����������Һ����ϡ�����У�Ba2++SO42-�TBaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��O2��=0.2mol/��L•s�� | B�� | v��SO3��=8mol/��L•min�� | C�� | v��SO2��=6mol/��L•min�� | D�� | v��O2��=6mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܵ���ʵ��ܶȻ�ԽС���ܽ��Խ�� | |
| B�� | ����ͨ��������Ӧʹ����������ȫ���� | |
| C�� | ���ܵ���ʵ��ܽ�ƽ����һ�ֶ�̬ƽ�� | |
| D�� | AgCl�����ڵ�Ũ�ȵ�NaCl��CaCl2��Һ�е��ܽ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t2��t3 | t4��t5 | t5��t6 |
| K1 | K2 | K3 |
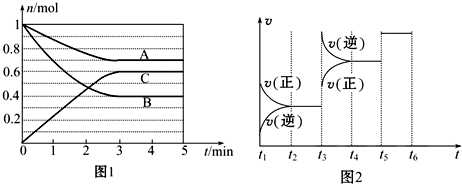
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com