
【题目】下列关于有机化合物的说法正确的是( )
A. 按系统命名法,化合物![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
B. 丙烯分子中,最多有7个原子共面
C. 蔗糖和淀粉的水解产物相同且均为葡萄糖
D. 向鸡蛋清中加入Pb(CH3COO)2或(NH4)2SO4溶液均会产生沉淀,两者的原理相同
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的稀盐酸,结果偏高的是
A. 在容量瓶中定容时,俯视刻度线
B. 用量筒量取浓盐酸时,俯视刻度线
C. 转移溶液后,未洗涤烧杯和玻璃棒就直接定容
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:
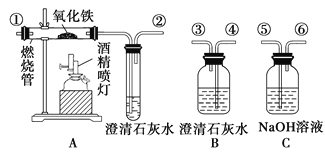
(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如图1:

(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置图2模拟“联合制碱法”的第一步反应.

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 .
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂.
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2mL.则纯碱样品中NaHCO3质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有18000公里的大陆海岸线,海洋资源丰富,品种繁多。
(1)工业上利用海水制取溴单质,一般先用空气或水蒸气吹出卤水中的单质溴,再用SO2将其还原吸收。某研究性学习小组模拟上述过程提取溴,其装置如图所示:

①所用仪器的接口连接顺序是d→__________,e→b_______→f。
②A中发生反应的化学方程式为_____________________________________。
③溶液Z是______________________;C中仪器名称为______________________。
④你认为本实验的不足之处是____________________________________。
(2)某小组测定含溴卤水中溴元素的总量。
①该小组设计的实验方案:上述操作完成后,取C中溶液15.0 mL,加入适量HNO3溶液酸化,再加入足量AgNO3溶液,过滤,测定产生沉淀的质量。此方案不可行的主要原因是_________________(不考虑实验装置及操作失误的原因);
②请为该小组设计一个可行的实验方案_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
Q | I1 | I2 | I3 | I4 | I5 | … |
电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W原子的价电子排布图为_______________________________。
(2)化合物X 2W2的电子式______________,化合物XYZ的结构式________________。
(3)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(4)YW2中的化学键类型为_________共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有________(要求写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A. ①② B. ③④ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有共价键的化合物一定是共价化合物
B. Na2O2中既含有离子键又含有非极性共价键
C. KOH中只含有共价键
D. KI和HI中化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4(g) ![]() N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ![]() 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H_____________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com