
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 除去SO2中少量HCl,将其通入饱和的Na2SO3溶液 | |
| C. | 在饱和氯水中Na+、K+、Cl-、CO32-能大量存在 | |
| D. | 向Ba(HCO3)2溶液中加入过量KOH溶液发生反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
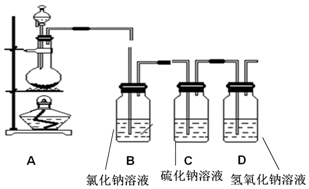
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Mg2+、Ca2+、CO32-、NO3- | D. | OH-、Fe3+、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.4mol/LNH4Cl溶液和0.2molNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| B. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | 在相同条件下,NaHCO3溶液和NaHSO3溶液中,水的电离平衡均被促进 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com