
 SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:分析 (1)①铜的原子序数为29,Cu2+核外有27个电子,每个电子的运动状态各不相同;根据二氧化硫中S原子的价层电子对数判断;
②CuCl2与SO2反应生成CuCl沉淀和硫酸;
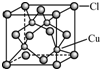
③根据晶体结构特点分析Cl原子的配位数;.
(2)根据中心原子的价层电子对数判断,价层电子对数=成键电子对数+孤电子对数;根据化合物中元素化合价规律和8电子稳定结构分析;Ga为第四周期、第IIIA族元素,原子核外有31个电子,分四层排布,最外层有3个电子.
解答 解:(1)①根据铜的原子序数为29,其核外有29个电子,失去2个电子形成Cu2+,则Cu2+核外有27个电子,每个电子的运动状态各不相同,所以有27种运动状态不同的电子;二氧化硫中S原子的价层电子对数=2+$\frac{1}{2}$(6-2×2)=3,而且含有1个孤电子对,所以SO2的空间构型为V形;
故答案为:27;V形;
②CuCl2与SO2反应生成CuCl沉淀和硫酸,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加热\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加热\;}}{\;}$2CuCl↓+4H++SO42-;
③从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,故答案为:4.
(2)[SbCl2+]中Sb的价层电子对数=2+$\frac{1}{2}$(5-1+2×1)=3,则Sb的杂化类型为sp2,[GaCl2+]中Ga的价层电子对数=2+$\frac{1}{2}$(3-1+2×1)=2,则Ga的杂化类型为sp;
[SbCl2+][GaCl4-]中阳离子Sb呈+3价属合N族元素价键规律,阴离子Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价属合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-];
Ga为第四周期、第IIIA族元素,原子核外有31个电子,分四层排布,最外层有3个电子,其电子排布式为:[Ar]3d104s24p1;
故答案为:sp2;sp;[SbCl2+][GaCl4-];[Ar]3d104s24p1.
点评 本题综合考查物质的结构与性质知识,侧重于杂化类型的判断、电子排布式、分子的立体构型、离子方程的书写等知识,题目难度中等,注意把握杂化类型的判断方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>④>② | D. | ④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
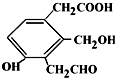 则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )
则Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
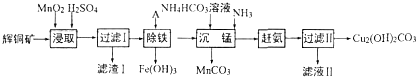
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
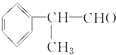 )是一种重要的化工原料,其合成路线如下
)是一种重要的化工原料,其合成路线如下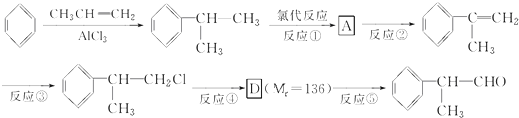
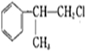 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$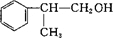 +NaCl.
+NaCl.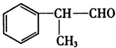 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$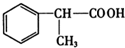 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.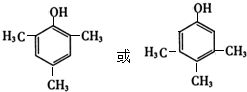 .
.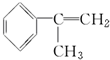 为原料制备
为原料制备 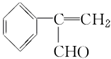 的化学方程式(无机试剂任用).
的化学方程式(无机试剂任用). +Br2→
+Br2→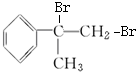 、
、 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$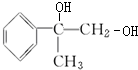 +2NaBr、
+2NaBr、 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2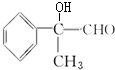 +2H2O、
+2H2O、 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH(CH3)CH(CH3)OH 3-甲基-4-戊醇 | |
| B. |  3-甲基丁烯 3-甲基丁烯 | |
| C. |  2-甲基丁烷 2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “四中子”不显电性 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com