
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2H2O═2H2↑+O2↑ | D. | Na2O+H2O═2NaOH |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
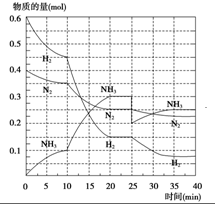 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纤维素的水解难于淀粉的水解 | |
| B. | 碘化钾溶液能使淀粉变蓝 | |
| C. | 多糖一般没有还原性,不能发生银镜反应 | |
| D. | 用淀粉制酒精仅发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (填结构简式);
(填结构简式);查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 确定碳酸氢钠固体中是否含有碳酸钠.把固体溶于水中,加入澄清石灰水 | 有白色沉淀生成 | 碳酸氢钠固体中含有碳酸钠 |
| C | 将NO2球浸泡在热水中 | 红棕色变浅 | 反应2NO2?N2O4的△H<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀变为黄色 | Ksp(AgI)<Ksp (AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com