
CS2和S2Cl2都是硫的重要化合物,在工业上有广泛的用途。二者的部分性质如下:
|
|
熔点/℃ |
沸点/℃ |
密度/g·cm—3[来源 |
水 |
|
CS2 |
—110.8 |
46.5 |
1.26 |
难溶 |
|
S2Cl2 |
—76 |
138 |
1.75 |
水解 |
(1)①在 CS2+3Cl2=CCl4(g) +S2Cl2反应中,化合价没发生变化的元素是 。
②在CS2和S2Cl2中,含有非极性键的是 。
(2)以CS2或单质硫做原料与氯气反应都可以制得S2Cl2。下图是实验室里通过在熔融的单质硫中通入少量氯气的方法制取S2Cl2的装置(夹持装置、加热装置均已略去)。
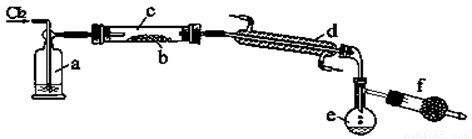
①装置a中的试剂是 ,其作用是 ;
装置d的名称是 ,其作用是 。
②该实验的操作顺序应是 (用序号表示)。
A.加热装置c B.通入Cl2 C.通冷凝水 D.停止通入Cl2
E.停止加热装置c
③f装置中的试剂是 ,其作用是 。
(1)①C(或碳)(2分)。②S2Cl2
(2)①浓硫酸,干燥剂(或除去Cl2中的水蒸气);冷凝器(管),将S2Cl2气体液化。
②BCAED或CBAED。③碱石灰;防止空气中的水蒸气进入e,吸收Cl2(2分,只要有这两个要点即给2分,多答不扣分,答对一个要点给1分。)。
【解析】
试题分析:(1)CS2中S是-2价,C是+4价,CCl4中C是+4价,Cl是-1价,S2Cl2中S是+1价,Cl是-1价,可知化合价没发生变化的元素是C;根据化合价推出它们的结构式为S=C=S和Cl-S-S-Cl,S2Cl2中含有非极性键;
(2)①因为S2Cl2能与水发生水解反应,整个制取装置不能有水,因此氯气通入前要干燥,装置a中的试剂为浓硫酸起干燥剂作用;生成物S2Cl2常温下是液体,需要冷凝处理,装置d的名称是冷凝管,将S2Cl2气体液化;
②实验操作注意,在开始反应之前一定要先通入氯气排尽装置中的空气,再进行加热,以免副反应发生,当反应结束停止加热后,还需继续通入氯气,排除装置中残留的S2Cl2气体;
③尾气吸收可以用碱石灰来吸收氯气,同时还可以防止空气中的水分进入e装置与S2Cl2发生水解。
考点:非金属元素及其化合物,制备实验方案的设计。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水 | |
| CS2 | -110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | -76 | 138 | 1.75 | 水解 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com