
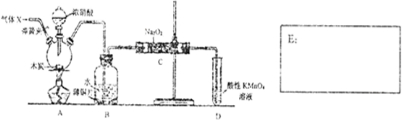
分析 A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
(1)一氧化氮容易与空气中的氧气反应生成二氧化氮;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,据此描述反应现象;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(5)根据发生的反应①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算.
解答 解:(1)A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,为防止装置中空气中的氧气氧化生成的一氧化氮,应先通入氮气排尽装置内的空气,故答案为:N2;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,所以会看到的现象为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝,故答案为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,验证操作为:取少量样品于试管中,向其中滴加酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明有亚硝酸钠,若有使澄清石灰水变浑浊的气体产生,证明有碳酸钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳,图为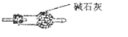 ,
,
故答案为:Na2CO3、NaOH;取少量样品于试管中,向其中滴加酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明有亚硝酸钠,若有使澄清石灰水变浑浊的气体产生,证明有碳酸钠; ;
;
(5)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2═2NaNO2,则有C~4NO2~$\frac{4}{3}$NO~$\frac{2}{3}$Na2O2~$\frac{4}{3}$NaNO2,所以1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为$\frac{3.12g}{78g/mol}$×$\frac{3}{2}$×12g/mol=0.72g,故答案为:0.72.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,掌握物质的性质是解题关键,题目难度较大.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 9.2g | B. | 8.6g | C. | 8g | D. | 7.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
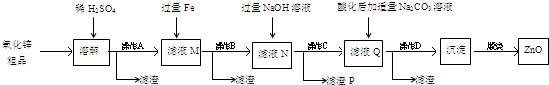
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液【Ba(OH)2溶液】 | B. | FeCl2溶液【KSCN溶液】 | ||
| C. | KI【淀粉溶液】 | D. | NaOH溶液【Ba(OH)2溶液】 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com