

| A. | 该反应为放热反应 | B. | 加催化剂能降低该反应焓变 | ||
| C. | A-B的键能为bkJ•mol-1 | D. | 该反应的反应热为△H=(a-b)kJ•mol-1 |
分析 A、依据图象分析判断1molA2和1molB2反应生成2molAB,产物的能量高于反应物的能量;
B、催化剂只改变反应速率,不影响反应热大小;
C、A-B的键能为断裂1mol化学键吸收能量值;
D、反应热△H=反应物能量总和-生成物能量总和.
解答 解:A、依据图象分析判断1molA2和1molB2反应生成2molAB,产物的能量高于反应物的能量,为吸热反应,故A错误;
B、催化剂不影响反应热的大小,故B错误;
C、A-B的键能为0.5bkJ•mol-1,故C错误;
D、反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,故D正确;
故选D.
点评 本题考查了化学反应的能量变化,图象分析判断,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 太阳能、地热能、核能、化石燃料等均属于“新能源” | |
| B. | 减少含碳物质做燃料符合“低碳”理念 | |
| C. | 图中转化途径不能体现“节能减排”的思想 | |
| D. | 节约用电不能减少CO2的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
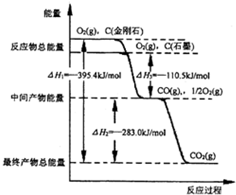 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | ||
| C. | 恒温恒容通入氢气 | D. | 加入催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com