
分析 (1)氢氧化铜与稀盐酸反应生成硫化铜水,氢氧化铜需要保留化学式;
(2)实验室中用碳酸钙与强酸反应制取二氧化碳气体;
(3)碳酸钠与稀硫酸反应生成硫酸钠、二氧化碳和水,可以用稀硫酸除去硫酸钠中的碳酸钠.
解答 解:(1)稀盐酸和氢氧化铜反应的离子反应为:2H++Cu(OH)2=Cu2++2H2O,
故答案为:2H++Cu(OH)2=Cu2++2H2O;
(2)实验室中制取二氧化碳的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)除去Na2SO4溶液中的Na2CO3杂质,可用稀硫酸将碳酸钠转化成硫酸钠,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,
故答案为:稀硫酸;CO32-+2H+=H2O+CO2↑.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
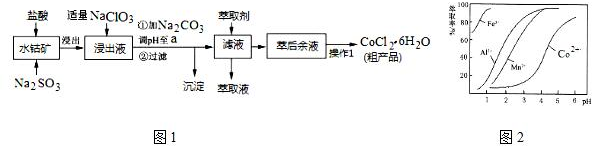
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3- | |
| B. | 将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 | |
| C. | t℃<25℃ | |
| D. | ac线上的任意一点溶液均有c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
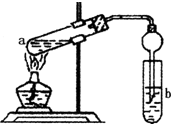 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com