
在2L的密闭容器中进行反应:3H2+N2 2NH3,经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol•l﹣1•s﹣1.则这段时间为()
2NH3,经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol•l﹣1•s﹣1.则这段时间为()
A. 10s B. 20s C. 30s D. 40s
考点: 化学反应速率和化学计量数的关系.
专题: 化学反应速率专题.
分析: NH3的物质的量增加0.8mol,反应速率之比等于化学计量数之比可知氨气的速率,结合v=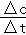 计算时间.
计算时间.
解答: 解:一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol•l﹣1•s﹣1,
由反应速率之比等于化学计量数之比,
则在这段时间内用NH3表示的平均反应速率为0.01mol•l﹣1•s﹣1,
0.02mol•l﹣1•s﹣1=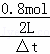 ,
,
解得△t=20s,
故选B.
点评: 本题考查反应速率的计算,明确反应速率与化学计量数成正比即可解答,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.某课外小组设计了如下装置,证明乙烯中混有CO2、SO2,并回答下列问题:
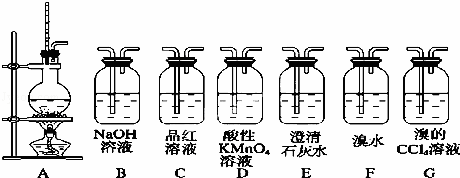
(1)装置A是乙烯的发生装置,图中一处明显的错误是 ,将反应后的混合气体通入到溴水当中,可能发生的化学反应方程式是: 、 ;
(2)若要检验装置A中所得气体含有SO2,可将混合气体直接通入 (填代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通入 装置,然后通入D装置;
(3)该小组将从装置A出来的混合气体依次通过B、E、F,发现石灰水中无明显变化,则F中出现的现象为 ;
(4)若要将三种气体全部检验出来,且要求所用的试剂瓶最少,则气体从A出来依次通过的装置先后顺序是(假设试剂足量) .
查看答案和解析>>
科目:高中化学 来源: 题型:
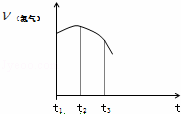
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是镁条与,t2~t3速率变化的主要原因是;反应的方程式M.
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1 mol·L-1和0.4 mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A.2.4 g B.3.2 g
C.6.4 g D.9.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于纯净物、混合物、强电解质、弱电解质的正确组合是()
纯净物 混合物 强电解质 弱电解质 非电解质
A 纯盐酸 水煤气 硫酸 醋酸 干冰
B 冰醋酸 福尔马林 硫酸钡 亚硫酸 二氧化硫
C 油酯 淀粉 苛性钾 氢硫酸 碳酸钙
D 重水 纤维素 氯化钠 次氯酸 氯气
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 0.1 mol•L﹣1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl﹣、MnO4﹣
B. 0.1 mol•L﹣1 FeCl2溶液:K+、Na+、SO42﹣、NO3﹣
C. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
D. 0.1mol•L﹣1NaHCO3溶液:K+、AlO2﹣、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可实现如图所示物质之间的转化.
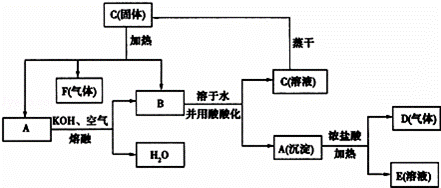
已知D为黄绿色气体,请填空:
(1)写出下列反应的化学方程式:
①C固体加热: A→B:.
(2)写出下列反应的离子方程式:
①A→D+E:;②B→C+A:.
查看答案和解析>>
科目:高中化学 来源: 题型:
埋藏在地下的青铜器锈蚀过程可表示为:
Cu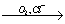 CuCl
CuCl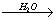 …→X.X由两种物质X1和X2组成,X1和X2都由四种元素构成。
…→X.X由两种物质X1和X2组成,X1和X2都由四种元素构成。
I、定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2受热分解的产物不能使澄清石灰水交浑浊,但两者均有水珠产生。
II、定量测定X1和X2组成:某兴趣小组用下图实验装置分别对X1和X2做热分解实验(夹持装置已省去).实验结束后,硬质玻璃管内均残留黑色固体,装置B和C的质量均增加。
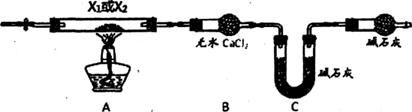
试回答下列问题:
(1)X1、X2均含有的元素有______________________。
青铜器出土后防止青铜器继续锈蚀的关键措施是_________________________________。
(2)利用上述装置进行实验时,会对判断A装置中反应是否完全进行带来困难,为解决此问题.可将B改为内装浓H2SO4的洗气瓶,判断反应完全的现象为___________。用经改装的装置.
某同学进行正确操作。最终得出的测定结果仍有误差,原因是___________(回答一点即可).
(3)在实验装置和实验操作正确的前提下,进行X1的热分解实验。经测定。装置B和C中质量增重之比△m(B):△m(C)=9:22,X1的化学式___________。X1热分解的化学方程式为______________________
(4)若测得X2中铜元素的质量分数为59.67%,则X2的化学式为______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com