
����P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ����ͼ�еġ�H��ʾ����1mol��������ݣ���
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ_____________________________________��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ______________________________________��
��3��P��Cl2��������Ӧ����1molPCl5��
��H3��_________��P��Cl2һ����Ӧ����1molPCl5�ġ�H4__________��H3 (����ڡ�����С�ڡ����ڡ�)��
��4��PCl5������ˮ��ַ�Ӧ���������������ᣬ�仯ѧ����ʽ��__________________________��
 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g)2NO2(g)�����¶����ߣ�����������ɫ���� ��
��
�ش��������⣺
(1)��Ӧ�Ħ�H________0(����ڡ���С�ڡ�)��100 ��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60 sʱ�Σ���Ӧ����v(N2O4)Ϊ__________mol��L��1��s��1����Ӧ��ƽ�ⳣ��K1Ϊ______________��
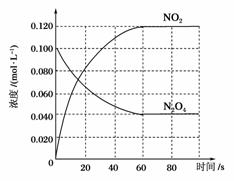
(2)100 ��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c(N2O4)��0.002 0 mol��L��1��s��1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣
��T________100 ��(����ڡ���С�ڡ�)���ж�������______________________________��
����ʽ�����¶�Tʱ��Ӧ��ƽ�ⳣ��K2______________��
(3)�¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����________(�����Ӧ�����淴Ӧ��)�����ƶ����ж�����______________________________________________________ ___________ _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����β����NOx�����������������������㷺��ע��
��1��ij��ȤС����������������Ϣ��
N2(g)+ O2(g)= 2NO(g) ��H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) ��H= - 483.6 kJ/mol
��Ӧ2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) ��H=________��
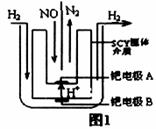 ��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]���ٵ缫AΪ____�����缫��ӦʽΪ_______________��
��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]���ٵ缫AΪ____�����缫��ӦʽΪ_______________��
��3����Ⱦ��NO��NO2Ҳ�������ռ���Һ���գ��������������壬�÷�Ӧ�����ӷ���ʽΪ______________________________________________��ֻ��NO2Ҳ����NaOH��Һ��Ӧ������NaNO2 ��NaNO3 ������ij�ռ���Һ��ȫ����n mol NO2��m mol NO��ɵĻ�����壬��������Һ��c(NO3��)�� c(NO2��) = 1��9����ԭ���������NO2��NO�����ʵ���֮��n��m =_______________ ��
��4�������йغ���Ԫ����Һ��˵����ȷ����______________
A��c(NH4+)��ȵ�(NH4)2SO4��(NH4)2CO3��(NH4)2Fe(SO4)2��Һ�У�
c[(NH4)2Fe(SO4)2] �� c[(NH4)2SO4]��c[(NH4)2CO3]
B�������£��������pH=13��NaOH��Һ��pH=1��HNO2��Һ��ϣ�������Һ��
c(Na+)��c(NO2��)��c(OH��)��c(H+)
C��ij��Һ��ֻ����OH����H+��Cl����NH4+�������ӣ�������Ũ��c(NH4+)��c(Cl��)��c(OH��)��c(H+)������Һ��c(NH3��H2O) + c(NH4+)��c(Cl��)
D����NH4Cl��Һ�����Ʊ�NH4Cl����
E��ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�ã�����ΪK2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч
F����ӦNH3(g)+HCl(g)=== NH4Cl(s)�������¿��Է����У���÷�Ӧ�ġ�H<0
��5�� NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԡ�ԭ����
�������ӷ���ʽ��ʾ���������Һ�μӰ�ˮ����Һb Lʱ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫ ������������������ƶ���������Һ�а�ˮ��Ũ��Ϊ mol��L-1����NH3��H2O�ĵ���ƽ�ⳣ��ȡKb=2��10-5mol��L-1��
��6���ں����ܱ������У���������泥�NH2COONH4���ֽⷴӦ��
NH2COONH4��s��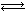 2NH3(g)+CO2(g)��
2NH3(g)+CO2(g)��
�� �����жϸ÷ֽⷴӦ�Ѿ��ﵽƽ����� ��
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�� ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒���������� (���������С�����䡱����ƽ�ⳣ��_________(���������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ������п�ۺ�6mol��L-1�Ĺ������ᷴӦ���������м�����������������ʱ���ܹ��ӿ췴Ӧ���ʣ��ֲ�Ӱ�����H2�������ǣ� ��
��ʯī ��CuO ��ͭ�� ������ ��Ũ���� ����ˮ����
A.�٢ۢ� B.�٢ۢ� C.�ڢܢ� D.�ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������·�Ӧ��X2(g)+Y2(g)  2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п����� �� ��
2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п����� �� ��
A��X2Ϊ0.2mol/L B��Y2Ϊ0.4mol/L C�� ZΪ0.3mol/L D�� ZΪ0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�����������˵����ȷ���� �� ��
A��1 mol��������2NA����ԭ��
B��14 g�����к�NA����ԭ��
C��2 L 0.3 mol��L��1 Na2SO4��Һ�к�0.6 NA��Na��
D��18 gˮ�������ĵ�����Ϊ8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ���ǣ�������
A������ϡ���ᷴӦ��2Fe+6H+��2Fe3++3H2��
B��̼�������CaCO3+2H+��Ca2++ CO2��+H2O
C. ����������������Һ��H++OH����H2O
D��ͭƬ������������Һ��Cu+Ag+��Cu2++Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и��������ܴ����������(����)
A��pH��12����Һ�У�K����Na����Br����AlO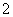
B����ɫ��Һ�У�H����K����MnO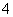 ��C2O
��C2O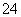
C��c(Fe3��)��0.1 mol��L��1����Һ�У�K����H����SCN����I��
D����ˮ�������c(OH��)��1.0��10��13 mol��L��1����Һ�У�Na����NH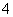 ��SO
��SO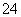 ��HCO
��HCO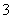
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������(NiMH)Ŀǰ�Ѿ���Ϊ��϶���������һ����Ҫ������͡�NiMH�е�M��ʾ���������Ͻ𡣸õ���ڳ������е��ܷ�Ӧ����ʽ�ǣ�Ni(OH)2��M===NiOOH��MH
��֪��6NiOOH��NH3��H2O��OH��===6Ni(OH)2��NO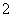
����˵����ȷ����(����)
A��NiMH��طŵ�����У������ĵ缫��ӦʽΪ��NiOOH��H2O��e��===Ni(OH)2��OH��
B����������OH�����Ӵ�����������Ǩ��
C���������������ĵ缫��Ӧʽ��H2O��M��e��===MH��OH����H2O�е�H��M��ԭ
D��NiMH����п�����KOH��Һ����ˮ����Ϊ�������Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com