
元素的化学性质主要决定于原子的()
A. 质子数 B. 中子数 C. 核外电子数 D. 最外层电子数
考点: 原子构成.
专题: 原子组成与结构专题.
分析: 元素的化学性质,与原子的最外层电子数关系非常密切,原子的最外层电子少于4个时,容易失去电子;多于4个少于8个时,容易获得电子.最外层为8个电子时,元素的化学性质最稳定.
解答: 解:A、决定元素种类的是核内质子数,元素的化学性质主要决定于原子的最外层电子数,故A错误;
B、决定核素种类的是核内质子数和中子数,元素的化学性质主要决定于原子的最外层电子数,故B错误;
C、元素的化学性质主要决定于原子的最外层电子数,和核外电子数无关,故C错误;
D、元素的化学性质主要决定于原子的最外层电子数,故D正确;
故选D.
点评: 本题考查元素的性质和最外层电子数的关系,核外最外层电子的得失决定元素的化学性质.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
如右图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是()
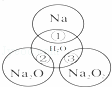
A. 反应③最多能产生0.05mol O2
B. 反应①的离子方程式为:Na+2H2O═Na++2OH﹣+H2↑
C. Na2O2中阴阳离子数目之比为1:1
D. ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol.
② 和 两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣) D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3•H2O),混合后溶液中c(NH4+)与c(Cl﹣)的关系c(NH4+) c(Cl﹣).
查看答案和解析>>
科目:高中化学 来源: 题型:
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
|
| A. | 放电时正极附近pH增大 |
|
| B. | 充电时阴极的电极反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣ |
|
| C. | 放电时电解质溶液中的阴离子向正极方向移动 |
|
| D. | 蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
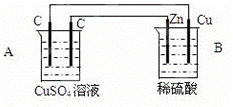
如图装置中,已知A、B两池溶液的体积均为200mL:
(1)判断装置的名称:A池为 ;
(2)A池中左边石墨棒为 极,电极反应式为 ;A池中总反应化学方程式为 4 ;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L.工作一段时间后取出电极,测得导线上通过了0.04mol e﹣.则反应后A池c(Cu2+)为 mol/L(体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是()
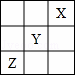
A. Z一定是活泼的金属元素
B. Y的最高价氧化物的水化物是一种强酸
C. Y的氢化物稳定性大于Z的氢化物稳定性
D. X、Y、Z各元素的最高正价与最低负价的绝对值之和均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中既属于氧化还原反应同时又是吸热反应的是()
A. Ba(OH)2•8H2O与NH4Cl反应 B. 镁与稀盐酸反应
C. 灼热的炭与CO2反应 D. 甲烷与O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知多硫化钠Na2Sx(x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:10,则x值是()
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是()
A. 升高温度,正反应速率增大,逆反应速率减小
B. 增大压强可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
C. 达到平衡后,升高温度或减小压强平衡都向逆反应方向移动
D. 使用催化剂,可以改变活化能,从而改变反应的△H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com