
【题目】下列有关仪器的使用正确的是
A.手持试管给试管内的物质加热
B.用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
C.用天平称量药品时用手直接拿砝码
D.用燃着的酒精灯去点燃另一盏酒精灯
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
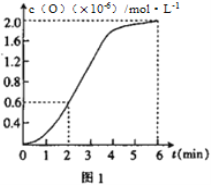
(2)已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
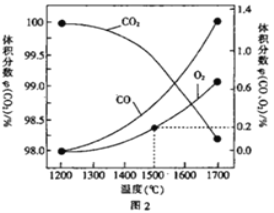
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=_________(计算结果保留1 位小数)。
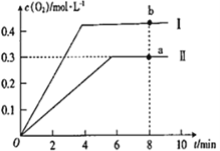
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
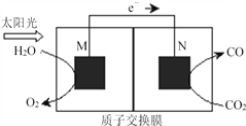
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用阿伏加德罗定律及其推论,判断下列说法正确的说法是( )
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比
D. 同温同体积下两种气体的物质的量之比等于压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物D.利用蒸馏法从海水中分离出淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:![]()
![]()
甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(2)工业合成氨的反应原理为![]() 某温度下,把10mol
某温度下,把10mol![]() 与28mol
与28mol![]() 置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为
置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为![]() ,则10min内该反应的平均速率
,则10min内该反应的平均速率![]() ______
______ ![]() ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数![]() ______
______ ![]() 欲增大氮气的平衡转化率,可采取的措施有 ______
欲增大氮气的平衡转化率,可采取的措施有 ______ ![]() 写一种措施即可
写一种措施即可![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com