
【题目】常温下,将 NaOH 溶液滴加到 HA 溶液中,测得混合溶液的 pH 的变化关系如下图所示(已知: ![]() )。下列叙述错误的是( )
)。下列叙述错误的是( )
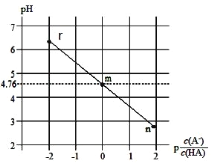
A. m 点:c(A-) = c(HA)
B. Ka(HA)的数量级为 10-4
C. 水的电离程度:m < r
D. r 点:c(H+) = c(A-)+c(OH-)c(Na+)
【答案】B
【解析】
A项,由图可知,m点所示溶液中:![]() =
=![]() =0,则m点时,c(A-) = c(HA),故A项正确;
=0,则m点时,c(A-) = c(HA),故A项正确;
B项,HA![]() H++A-,Ka(HA)=
H++A-,Ka(HA)=![]() ,m点
,m点![]() =
=![]() =0时溶液的pH=4.76,Ka(HA)=c(H+)=10-4.76,Ka(HA)的数量级为10-5,故B项错误;
=0时溶液的pH=4.76,Ka(HA)=c(H+)=10-4.76,Ka(HA)的数量级为10-5,故B项错误;
C项, 根据A项分析,m点时,c(A-)= c(HA),同样方法分析,r点时,c(A-) > c(HA),则r点加入的NaOH溶液大于m点,r点溶液中剩余HA小于m点,r点溶液中NaA大于m点,则水的电离程度:m < r,故C项正确;
D项,r 点存在电荷守恒关系:c(H+) +c(Na+)= c(A-)+c(OH-),所以c(H+) = c(A-)+c(OH-)c(Na+),故D项正确。
故答案选B。


科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
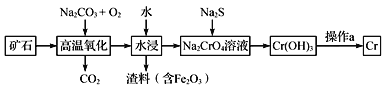
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式_______。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol·L-1的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度分别为:c(CrO42-)=0.0005 mol·L-1、c(HCrO4-)=0.1035 mol·L-1、c(Cr2O72-)=a mol·L-1、则a=______,KHCrO4溶液中c(OH-)______c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为________________________,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO42-的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出CrO42-在酸性条件下被Fe2+还原为Cr3+的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究有机物的方法有很多,常用的有①核磁共振氢谱②蒸馏③重结晶④萃取⑤红外光谱⑥过滤,其中用于分子结构确定的有____(填序号)。
(2)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(3)某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。如图是该有机物的质谱图,则其相对分子质量为______,分子式为________。
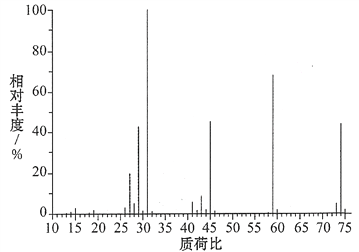
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 22.4 L(标准状况)氩气含有的质子数为18NA
B. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
C. 92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]() +CH3Cl
+CH3Cl![]()
![]() (甲苯)+HCl
(甲苯)+HCl
②CH2===CH2+ (乙苯)
(乙苯)
③![]() +3H2
+3H2  (环己烷)
(环己烷)
下列说法正确的是( )
A. 反应①、②、③均属于加成反应
B. 溴水中加入苯,二者可发生取代反应
C. 甲苯中所有原子一定在同一平面上
D. 能用溴水判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。反应原理如下:C3H8(g)![]() C3H6(g)+H2(g) △H1
C3H6(g)+H2(g) △H1
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8 发生反应,经过 10 min达到平衡状态,测得平衡时气体压强是开始的 1.75 倍。
①0 ~ 10 min内丙烯的生成速率υ(C3H6) =_________,C3H8 的平衡转化率为__________。
②下列情况能说明该反应达到平衡状态的是___________。
A.气体密度保持不变 B.[c(C3H6)·c(H2)]/c(C3H8)保持不变
C.△H1 保持不变 D.C3H8 分解速率与 C3H6 消耗速率相等
(2)总压强分别为 p1 和 p2 时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数如下图所示:
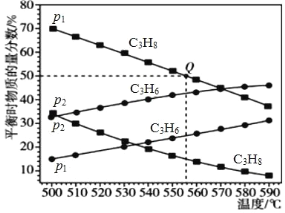
①压强:p1_____(填“>”或“<”)p2。
②为了提高反应速率和反应物的转化率,可采取的措施是_____。
③若 p1 = 0.1 MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数 Kp =_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④在 0.1 MPa、527℃条件下,向恒容密闭容器中通入丙烷和稀有气体,发生丙烷脱氢反应,随着![]() 的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
(3)在实际生产中,还可能存在如下副反应:
C3H8(g)![]() C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
则△H3=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,分子数目相同的是()
A. 22.4L氩气和1mol氢气
B. 2g氢气和16g氧气
C. 同温同压下2L氢气和2L水
D. 1mol常温常压下的氧气和标准状况下2g氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固定体积的密闭容器中存在化学平衡:a A (g) ![]() b B (g) + c C (g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中不正确的是
b B (g) + c C (g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中不正确的是
A. 无论a、b、c大小关系如何,平衡一定向正方向移动
B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率变大
D. 当反应再次达到平衡时,反应速率与原平衡时的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
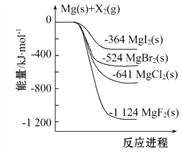
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com