
将两金属A、B分别用导线相连接,并同时插入电解质溶液中,发现A极的质量增加,则下列说法正确的是( )
A.金属活动性:A>B
B.A极是正极,电解质溶液可以是盐酸
C.B极是负极
D.要判断A极与B极是正极还是负极,还需考虑电解质溶液
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:填空题
化合物X是一种环境激素,存在如下转化关系:
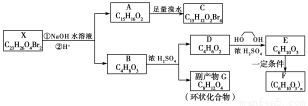
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H?NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题:
(1)下列叙述正确的是________。
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)________________________________________________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__________________________________________________。
(5)写出E→F反应的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移电子数目为0.2NA
D.标准状况下,18 g H2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:填空题
近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
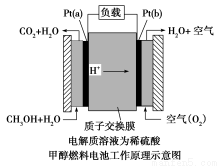
请回答下列问题:
(1)Pt(a)电极是电池的 极,电极反应式为 ;Pt(b)电极发生 反应(填“氧化”或“还原”),电极反应式为 。
(2)电池的总反应方程式为 。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有 mol。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:选择题
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是( )
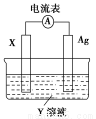
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-=Ag
D.外电路中的电子是从X电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )
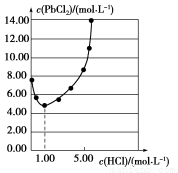
A.蒸馏水
B.1.00 mol·L-1盐酸
C.5.00 mol·L-1盐酸
D.10.00 mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:填空题
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
阳离子 | NH4+、H+、Na+ |
阴离子 | OH-、CH3COO-、Cl- |
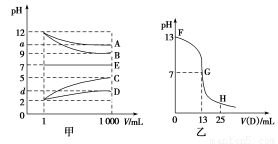
(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)  2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com