
| A. | 0.1mol•L-1 HA 中c(H+)=c(OH-)+c(A-), | |
| B. | 0.1mol•L-1 HA 与 0.1 mol•L-1NaOH 混合至溶液呈中性:c(Na+)<c(A-) | |
| C. | 0.1mol•L-1 NaA 中c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 0.1mol•L-1 HA中加入少量NaA固体,HA的电离常数减小 |
分析 A.HA溶液中存在电荷守恒,溶液中阴阳离子所带电荷相等;
B.物质的量浓度相等的HA和NaOH溶液混合,混合溶液呈中性,则c(H+)=c(OH-),溶液呈电中性,则溶液中阴阳离子所带电荷相等;
C.NaA是强碱弱酸盐,其溶液呈碱性,阴离子易水解,但水解程度较小;
D.弱电解质的电离平衡常数只与温度有关,与溶液的酸碱性无关.
解答 解:A.HA溶液中存在电荷守恒,溶液中阴阳离子所带电荷相等,根据电荷守恒得c(H+)=c(OH-)+c(A-),故A正确;
B.HA和NaOH溶液混合,混合溶液呈中性,则c(H+)=c(OH-),溶液呈电中性,则溶液中阴阳离子所带电荷相等,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(A-),则c(Na+)=c(A-),故B错误;
C.NaA是强碱弱酸盐,其溶液呈碱性,c(OH-)>c(H+),A-易水解,但水解程度较小,所以离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;
D.弱电解质的电离平衡常数只与温度有关,与溶液的酸碱性无关,所以HA的电离平衡常数不变,故D错误;
故选A.
点评 本题考查了弱电解质的电离,根据弱电解质电离、盐类水解特点来分析解答,并结合电荷守恒分析,离子浓度大小是学习难点,注意盐类水解是微弱的.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molCaC2晶体中含有的离子总数为3NA | |
| B. | 常温常压下,3g-CH3中含有的电子数为1.8NA | |
| C. | NA个HCl分子与22.4LH2和Cl2的混合气体所含有的原子数均为2NA | |
| D. | 80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.48 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
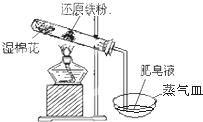 按如图所示装置进行铁与水的反应实验,请回答下列问题:
按如图所示装置进行铁与水的反应实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
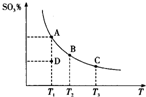 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )| A. | 在D点时,反应逆向进行 | |
| B. | 反应2SO2(g)+O2(g)?2SO3(g)的△H>0 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒压下向平衡体系中通入氦气,平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2K+中的“2”表示钾离子的个数是2 | |
| B. | 3CO2中“2”表示每个二氧化碳分子中含有2个氧原子 | |
| C. | Cu2+中的“2”表示铜的化合价是+2价 | |
| D. | H2O中的“2”表示一个水分子中含有的氢原子数是2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com