
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
分析 A.电子、电荷不守恒;
B.漏写生成氢氧化铜的离子反应;
C.碳酸钙在离子反应中保留化学式;
D.反应生成氢氧化铁和氯化铵.
解答 解:A.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.硫酸铜溶液与氢氧化钡溶液反应的离子反应为2OH-+Cu2++SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故B错误;
C.碳酸钙与稀盐酸反应的离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故C错误;
D.向FeCl3溶液中加入氨水的离子反应为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用铝合金制作门窗 | B. | 用铝合金制作飞机材料 | ||
| C. | 用金属铝制盛装碳酸饮料的易拉罐 | D. | 用金属铝制作电线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 蛋白质、纤维素、油脂、淀粉都是高分子化合物 | |
| C. | 石油裂化、煤的干馏、铝热反应都属于化学变化 | |
| D. | 乙烯常用作水果催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
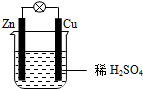
| A. | Cu为负极,Zn为正极 | B. | 电子从铜片经外电路流向锌片 | ||
| C. | 负极反应为:Zn-2e-═Zn2+ | D. | 该装置将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| B. | 3mol单质Fe与足量水蒸气完全反应,失去9NA个电子 | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 22.4L的Cl2与足量水反应,转移电子数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com