
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
A.X、M两种元素形成的化合物只能存在离子键
B.元素Y、Z、W形成的单质中,每1 mol它们的单质均含有NA个分子
C.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
D.元素W和M的某些单质可作为水处理中的消毒剂
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)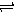 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C.其他条件不 变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
化合物A是合成天然橡胶的单体,分子式为C5H8,A的一系列反应如下(部分反应条件略去)
回答下列问题:
(1)A的结构简式为 ,化学名称是 ;
(2)B的分子式为 ;
(3)②的反应方程式为 ;
(4)①和③的反应类型分别是 , ;
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式为 ;(6)A的同分异构体中不含聚集双烯(C=C=C)结构单元的链状烃还有 种,写出其中互为立体异构体的化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是
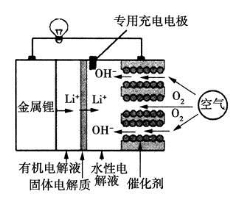
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:简答题
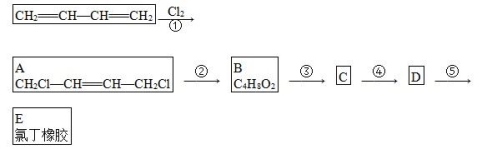
氯丁橡胶E(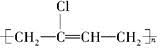 )的合成路线如下:
)的合成路线如下:
已知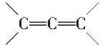 是不稳定结构。
是不稳定结构。
(1)氯丁橡胶中官能团的名称是________。
(2)②的反应条件和无机试剂是________。
(3)若A为反式结构,用结构简式表示A的结构是____________。
(4)④的化学方程式是______________________。
(5)B的同分异构体有多种,写出属于酯类且能发生银镜反应的所有同分异构体的结构简式:____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
下列离子方程式书写正确的是
A.硫酸铝溶液中滴加过量浓氨水:Al3++4NH3·H2O===AlO2-+4NH4+ +2H2O
B.乙酸钠溶液显碱性的原因:CH3COO-+H2O===CH3COOH+OH-
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-===SO32- +H2O
D.漂白粉放置在空气中变质:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:简答题
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
某温度下,将溶质质量分数为a%的KOH溶液蒸发掉m g水后恢复至原温度,恰好得到质量分数为2a%的KOH饱和溶液V mL,则下列说法中正确的是
A.该温度下KOH的溶解度为100a/(100-a)g
B.原溶液的质量为2m g
C.可以求算原溶液的物质的量浓度
D.保持温度不变,向原溶液中加入2a g KOH可达饱和
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
下列结论不正确的是
A粒子半径:S>S2->Cl-
B氢化物沸点:H2O>HF>HCl
C结合质子能力:OH->SiO>CO
D离子还原性:S2->I->Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com