
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:分析 (1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
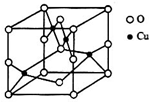
(2)利用均摊法可确定晶胞中氧离子的数目;
(3)F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键;
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键;能形成分子间氢键的物质熔沸点较高;
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式,B与N之间形成配位键,氮取子提供孤电子对;
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)根据均摊法可知晶胞中氧离子的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
(3)F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,所以故NF3不易与Cu2+形成配离子,
故答案为:F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键;
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式为sp3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,
故答案为:sp3;孤电子对;
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{25×4}{{N}_{A}}}{(365.1×1{0}^{-10})^{3}}$g/cm3=$\frac{25×4}{(365.1×1{0}^{-10})^{3}{N}_{A}}$g/cm3,
故答案为:分子间作用力;$\frac{25×4}{(365.1×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力及计算能力,涉及晶胞计算、原子杂化方式判断、配位键及氢键、原子核外电子排布等知识点,难点是晶胞计算及(5)题,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
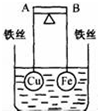 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
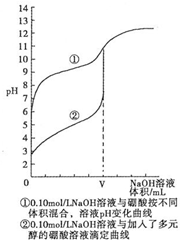
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

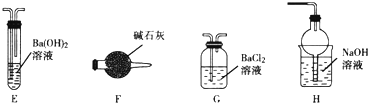
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
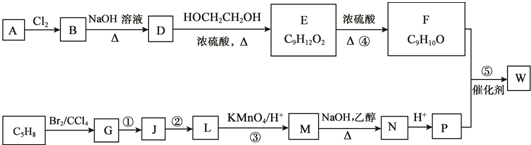
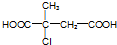 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.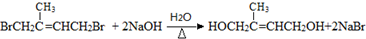 .
. .
.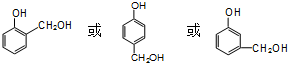 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
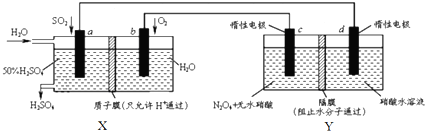
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com