
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ��� 
��1���Ʊ�����ѡ�õ�ҩƷΪ����������̺�Ũ���ᣬ����صĻ�ѧ��Ӧ����ʽΪ�� ��
װ��B�б���ʳ��ˮ����������
��2�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ����������ʱ�����Կ�����ɫ��Һ��Ϊɫ����������װ��D��������Һ����װ��E�У����۲쵽�������� ��
��3��װ��F����������NaOH��Һ�������ȣ���д����Ӧ�Ļ�ѧ����ʽ�� ��
��4��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η���
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | ��ˮ�Ȼ��� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����ȥCl2�е�HCl
MnCl2+Cl2��+2H2O����ȥCl2�е�HCl
��2���ƣ�E����Һ��Ϊ���㣬�²㣨���Ȼ�̼��Ϊ�Ϻ�ɫ
��3��2NaOH+Cl2�TNaCl+NaClO+H2O
��4��d
���������⣺��1���Ʊ�����ѡ�õ�ҩƷΪ����������̺�Ũ���ᣬ���ȷ�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����Ӧ�������Ȼ����ˮ������������ �����ʣ�װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl�����Դ��ǣ�MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O����Ӧ�������Ȼ����ˮ������������ �����ʣ�װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl�����Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����ȥCl2�е�HCl����2��D�����廯�ƣ�����D�л���ͨ����������ʱ���������廯�Ʒ�Ӧ�����嵥�ʣ����Կ�����ɫ��Һ��Ϊ�ƣ���������Ϊ����Һ����ɫ�仯Ϊ��ɫ����������װ��D�к��嵥�ʵ�������Һ���뺬�⻯�غ����Ȼ�̼��װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ��²㣨���Ȼ�̼��Ϊ�Ϻ�ɫ��
MnCl2+Cl2��+2H2O����ȥCl2�е�HCl����2��D�����廯�ƣ�����D�л���ͨ����������ʱ���������廯�Ʒ�Ӧ�����嵥�ʣ����Կ�����ɫ��Һ��Ϊ�ƣ���������Ϊ����Һ����ɫ�仯Ϊ��ɫ����������װ��D�к��嵥�ʵ�������Һ���뺬�⻯�غ����Ȼ�̼��װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ��²㣨���Ȼ�̼��Ϊ�Ϻ�ɫ��
���Դ��ǣ��ƣ�E����Һ��Ϊ���㣬�²㣨���Ȼ�̼��Ϊ�Ϻ�ɫ����3������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ���䷴Ӧ�Ļ�ѧ����ʽΪ��2NaOH+Cl2�TNaCl+NaClO+H2O��
���Դ��ǣ�2NaOH+Cl2�TNaCl+NaClO+H2O����4��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abc�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd��
���Դ��ǣ�d��
�����㾫�������ڱ��⿼���������ʵ�����Ʒ�����Ҫ�˽�ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1molH2(g)��1molBr2(g)��ȫ��Ӧ����2molHBr(g)�ų�102kJ������������ʽΪ��H2(g)��Br2(g)��2HBr(g)����֪��
H2(g) | Br2(g) | HBr(g) | |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�������kJ�� | 436 | a | 369 |
�����aΪ
A. 200 B. 260 C. 404 D. 230
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ��̫�ս��������ѣ�Ti��������Ȼ������Ҫ�Խ��ʯ��TiO2������ʽ���ڣ����ڽ��ʯ�۵�ߣ�Ϊ����Ti��ֱ���Ʊ����������ѣ��ڹ�ҵ�ϳ������ý�����ת�����۷е�ϵ͵�TiCl4���ٽ��л�ԭ�ķ��������ʯת����TiCl4�ķ�Ӧ����ʽ���£�
TiO2+2C+2Cl2�TTiCl4+2CO
��1��ָ���÷�Ӧ�������� �� ����������
��2����˫���ŷ��������ת�ƣ�
��3������6mol����ת�ƣ�����mol��ԭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ϡ���ᷴӦ�������˱�״����4.48L������
��1�����㷢����Ӧ���������ʵ���Ϊ���٣���д��������̣�
��2�������������Ũ��Ϊ0.5molL��1 �� ��������Ҫ��������Ϊ����
��3��������ϡ���������ܶ�Ϊ1.19g/cm3����������Ϊ36.5%��Ũ����ϡ�͵õ������Ũ�����������Ũ����molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��V��W��X��Y��Z��ԭ����������������������Ԫ����ɵľ��������У�n��r��u�����嵥�ʣ������Ϊ�����n�ǻ���ɫ���壬m����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬p����ɫҺ�壬q�ǵ���ɫ���塣���ǵ�ת����ϵ��ͼ��ʾ��

����˵����ȷ����
A. ʵ������ȡm��uʱ�����巢��װ�ÿ�����ͬ
B. ԭ�Ӱ뾶��W>X>Y
C. ��Ӧ�����ھ�Ϊ�û���Ӧ
D. n��t��Һ��Ӧʱ��t����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����������̼����������ŷ��������γɵ���Ҫԭ��
B.����β���е�NO��Ҫ���ɿ����еĵ�������ȼ���ĸ����²��뷴Ӧ���ɵ�
C.�����������ŷ��ǹ⻯ѧ�����γɵ���Ҫԭ��
D.ClO2��Ϊ����ǿ��ԭ�Կ�����ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊa%�����ʵ���Ũ��Ϊc molL��1��NaCl��Һ�������ܼ����ָ���ԭ�����¶ȣ������ʵ���Ũ�ȱ�Ϊ2c molL��1 �� ������������Ϊ������������û�о�����������NaCl��Һ���ܶȴ���1g/mL���� ��
A.����2a%
B.����2a%
C.��2a%
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���������������������װ�ã���ͼ�����Ի������Ʊ�����ϩ
��֪��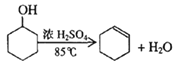


��1���Ʊ���Ʒ
��12.5mL�����������Թ�A�У��ټ���1mLŨ���ᣬҡ�Ⱥ�����״���ʣ�������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
�ٿ�״���ʵ�������___________������B��������___________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����____________________________________��
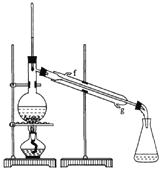
��2���Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��_________��(���ϻ���)����Һ����_________ (������)ϴ�ӡ�
a��KMnO4��Һ b��ϡH2SO4 c��Na2CO3��Һ
���ٽ�����ϩ����ͼװ��������ȴˮ��_______��������Ŀ����_________
���ռ���Ʒʱ�����Ƶ��¶�Ӧ��_________���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����___________
a������ʱ��70����ʼ�ռ���Ʒ
b��������ʵ����������
c���Ʊ���Ʒʱ���������Ʒһ������
��3���������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������_______________________��
a�������Ը��������Һ b���ý����� c���ⶨ�е�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com