
【题目】在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是
A.v(H2)=0.1 mol·(L·min)-1B.v(N2)=0.1 mol·(L·min)-1
C.v(N2)=0.2 mol·(L·min)-1D.v(NH3)=0.3 mol·(L·min)-1
【答案】C
【解析】
N2与H2在一定条件下反应产生NH3,反应方程式为:N2+3H2![]() 2NH3,根据物质反应转化关系,都转化为用N2浓度变化表示的反应速率,然后再比较其相对大小。
2NH3,根据物质反应转化关系,都转化为用N2浓度变化表示的反应速率,然后再比较其相对大小。
A. v(H2)=0.1 mol·(L·min)-1,则用N2的浓度变化表示反应速率为v(N2)=![]() v(H2)=
v(H2)=![]() ×0.1 mol·(L·min)-1≈0.033 mol·(L·min)-1;
×0.1 mol·(L·min)-1≈0.033 mol·(L·min)-1;
B. v(N2)=0.1 mol·(L·min)-1;
C. v(N2)=0.2 mol·(L·min)-1;
D. v(NH3)=0.3 mol·(L·min)-1,则用N2的浓度变化表示反应速率为v(N2)=![]() v(NH3)=
v(NH3)=![]() ×0.3 mol·(L·min)-1=0.15 mol·(L·min)-1;
×0.3 mol·(L·min)-1=0.15 mol·(L·min)-1;
可见数值最大为0.2 mol·(L·min)-1,故合理选项是C。


科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
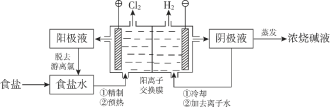
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
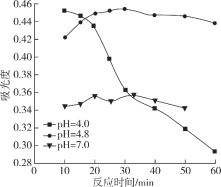
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、M相互转化关系如下。下列有关说法不正确的是

A. 可用碳酸氢钠区别X与Y
B. Y中所有原子在同一平面上
C. X、Y、M均能发生加成、氧化和取代反应
D. X环上的二氯代物共有11种(不考虑顺反异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2 min,用 Z 的浓度变化表示的平均反应速率 v(Z)=___________。
(3)_____min时, 反应达到平衡,容器内混合气体的平均相对分子质量比起始时_____(填“增大”“减小”或“不变”下同);混合气体的密度______。
(4)改变下列措施能加快反应速率的是_____(填序号,下同)。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.扩大容器体积 E.升高温度 F.选择高效的催化剂
(5)下列能作为判断反应达到平衡的依据的是_____。
A.体系压强不变 B. 2v(Z)正=3v(X)逆 C.三种气体的总质量不变 D.X 的转化率为 30%
(6)将 a mol X 与 b mol Y 的混合气体通入 2 L 的密闭容器中并发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中 a∶b=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风性关节病的发病机理和尿酸钠有关。室温下,将尿酸钠( NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5 mol2·L-2,Ka(HUr)=2.0×10-6 mol·L-1。下列说法正确的是

A.上层清液中,c(![]() )= 7.0×10-2 mol·L-1
)= 7.0×10-2 mol·L-1
B.M→N的变化过程中,c(Na+)·c(Ur-)的值将逐渐减小
C.当c(HUr)=c(Ur-)时,c(Cl-)>c(Ur-)
D.当pH=7时,2c(Na+)=c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:A.O2和O3(臭氧);B.![]() 和
和![]() ;
;
C.CH3CH2CH2CH3和![]() ; D.
; D. 和
和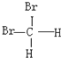 ;
;
E.甲烷和戊烷; F.CH3COOCH3与 CH3CH2COOH;
G.金刚石和石墨; H.液氯与氯气。
(1)_____组两物质互为同位素。
(2)_____组两物质互为同素异形体。
(3)_____组两物质属于同系物。
(4)_____组两组物质互为同分异构体。
(5)_____组中的物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃双环[2.2.1]庚烷的结构简式如图所示,下列关于该化合物的说法错误的是
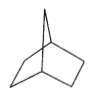
A. 与环庚烯互为同分异构体
B. 二氯代物结构有9种
C. 所有碳原子不能处于同一平面
D. 1mol双环[2.2.1]庚烷完全燃烧至少需要10 molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)。
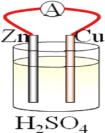
(1)负极是__(填“铜”或“锌”),__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式___;正极是__(填“铜”或“锌”)__电子(填“失去”或“得到”),发生__反应(填“氧化”或“还原”),电极反应方程式__。
(2)电流由___流向___(填“铜”或“锌),铜片上观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如下图所示:
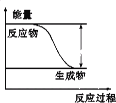
(1)该反应为_______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_________极(填“正”或“负”)。铜片上产生的现象为_________,外电路中电子由________电极(填“Fe”或“Cu”,下同),向________电极移动。
(4)若依据氧化还原反应:Cu2++Fe=Cu+Fe2+设计的原电池如下图所示,请回答下列问题:
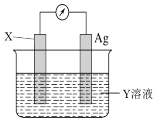
电极X的材料是________,电解质溶液Y是_________,X电极上发生的电极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com