



 溶液的浓度应为 mol/L。
溶液的浓度应为 mol/L。 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:不详 题型:单选题
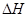 的绝对值均正确)( )
的绝对值均正确)( )| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiCl4+H2 ="=" SiHCl3+HClΔH=" +31" kJ/mol |
| B.SiCl4+H2 ="=" SiHCl3+2HCl ΔH=" -31" kJ/mol |
| C.SiCl4(g)+H2(g) ="=" SiHCl3(g)+HCl(g) ΔH="+31" kJ/mol |
| D.SiCl4(g)+H2(g) ="=" SiHCl3(g)+2HCl(g) ΔH=" -31" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


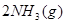 △H=
△H=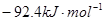 ,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )
,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是( )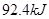

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g) △H>0 ,反应速率为 u1,N2+3H2
2CO(g) △H>0 ,反应速率为 u1,N2+3H2 2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为 ( )
2NH3 △H<0反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为 ( ) | A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
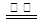 CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ①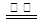 H2O(g) ΔH=E3 ③
H2O(g) ΔH=E3 ③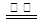 CO2(g) ΔH=E4④ ,试回答下列问题:
CO2(g) ΔH=E4④ ,试回答下列问题: _____(填“大于”、“等于”、“小于”)途径II放出的热量。
_____(填“大于”、“等于”、“小于”)途径II放出的热量。 是_____________________________________。
是_____________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。
 H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 态水的热化学反应方程式:
态水的热化学反应方程式:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com