
【题目】已知 M、N 是合成某功能高分子材料的中间产物,下列关于 M、N 说法正确的是
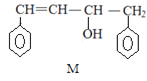
![]()
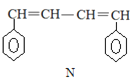
A.M、N 都属于芳香烃,但既不是同系物,也不是同分异构体
B.M、N 分别与液溴混合,均发生取代反应
C.M、N 均能使酸性高锰酸钾溶液褪色
D.M、N 分子所有原子均可能共平面
【答案】C
【解析】
A.M中除了含有C、H元素外还含有O元素;
B.碳碳双键能和溴发生加成反应;
C.从苯环的侧链、不饱和键、羟基的还原性等角度思考;
D.苯、乙烯分子中所有原子共平面,且共价单键可以旋转。
A.M中除了含有C、H元素外还含有O元素,所以M是烃的含氧衍生物,故A错误;
B.碳碳双键能和溴发生加成反应,苯环和液溴在溴化铁作催化剂条件下发生取代反应,故B错误;
C.M、N的与苯环相连的侧链的第一个碳上均有H,且两者的侧链上有不饱和键,均能使酸性高锰酸钾溶液褪色,故C正确;
D.苯、乙烯分子中所有原子共平面,且共价单键可以旋转,所以N中所有原子可能共平面,M中有饱和碳原子,它连接的4个原子构成的是四面体结构,所以M中所有原子不可能共面,故D错误;
故选C。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
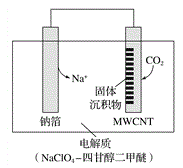
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素-3-羧酸![]() 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。
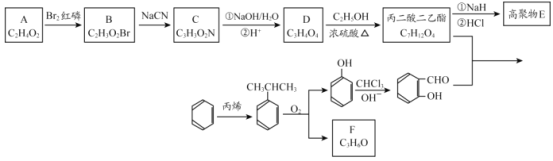
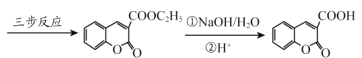
已知:
RCOOR′+ R″OH ![]() RCOOR″ + R′OH(R 代表烃基)
RCOOR″ + R′OH(R 代表烃基)
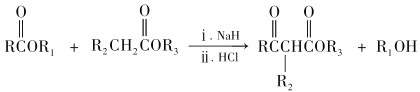
(1)A和B均有酸性,A 的结构简式__________;苯与丙烯反应的类型是_______。
(2)F 为链状结构,且一氯代物只有一种,则F 含有的官能团名称为__________。
(3)D→丙二酸二乙酯的化学方程式:_______。
(4)丙二酸二乙酯在一定条件下可形成聚合物 E,其结构简式为:________。
(5)写出符合下列条件的丙二酸二乙酯同分异构体的结构简式:________。
①与丙二酸二乙酯的官能团相同;
②核磁共振氢谱有三个吸收峰,且峰面积之比为 3:2:1;
③能发生银镜反应。
(6)丙二酸二乙酯与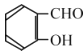 经过三步反应合成
经过三步反应合成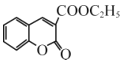 。
。
请写出中间产物的结构简式。
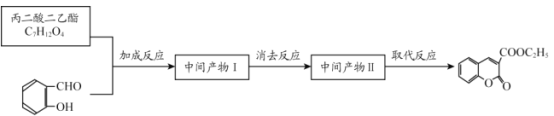
中间产物I__________;中间产物II___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
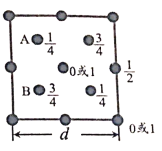
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)可用作有机合成的催化剂。某课题组以铬铁矿为主要原料制备Cr2O3。铬铁矿主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质,工艺流程如图所示。下列说法错误的是( )
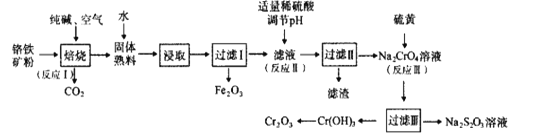
A.Fe(CrO2)2中Cr元素的化合价为+3
B.“焙烧”时,1molFe(CrO2)2参加反应转移4mole-
C.“滤渣”成份是Al(OH)3
D.“反应Ⅲ”的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3+3S2O32-+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数。 下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.对于反应:3A(g)+2B(g) 4C(s)+2D(g)的化学平衡常数表达式为 K= ![]()
C.KW 不是水的电离平衡常数
D.难溶电解质 AB2 饱和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,则 Ksp 值为 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②达到平衡后测得体系压强是起始时的![]() ,则该反应的平衡常数Kp=____kPa)2。
,则该反应的平衡常数Kp=____kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
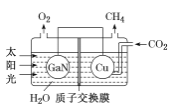
①该装置工作时H+移向____(填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___。
②该装置每产生1 mol CH4,左极室溶液质量减少____g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。
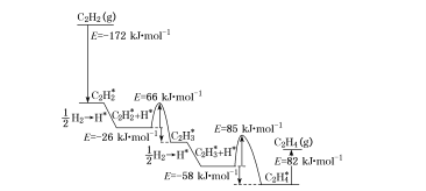
上述吸附反应为 ____填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ![]() mol-1,该步骤的化学方程式为____。
mol-1,该步骤的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____。仪器甲、乙接口的连接方式如下:A连接___,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为_____。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______,验证方法__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com