
| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
分析 A.电解质溶液促胶体聚沉;
B.二者反应生成氢氧化铁沉淀,得不到氢氧化铁胶体;
C.依据胶体的丁达尔效应;
D.依据胶体电泳的性质解答.
解答 解:A.把盐卤或石膏加入豆浆制成豆腐,利用的是胶体聚沉,故A正确;
B.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀为氢氧化铁成,得不到氢氧化铁胶体,故B错误;
C.放电影时,放映室射到屏幕上的光柱,属于胶体的丁达尔效应,故C正确;
D.在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深,属于胶体的电泳,故D正确;
故选:B.
点评 本题考查了胶体的性质,熟悉胶体的聚沉、电泳、丁达尔效应是解题关键,注意氢氧化铁胶体的制备,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜器出现铜绿 | B. | 过氧化钠作供氧剂 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面牛成致密的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
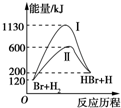
| A. | 反应热:过程Ⅰ>过程Ⅱ | |
| B. | 两个过程的反应热是相同的,△H=-80 kJ•mol-1 | |
| C. | 过程I中使用了催化剂 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生还原反应 | |
| B. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| C. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| D. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti在周期表中位置相同,都在第4纵行 | |
| C. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的物理性质相同 | |
| D. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
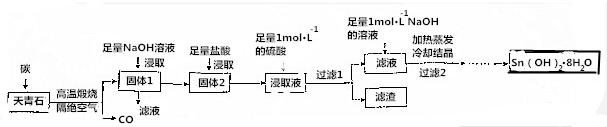
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
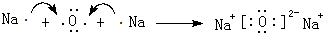 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com