
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、![]() 、
、![]()
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、![]() 、
、![]()
C.0.1mol/LNH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
D.0.1mol/LFeCl3溶液中:Na+、![]() 、S2-、
、S2-、![]()
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )

A.电解前CuSO4溶液的物质的量浓度为2 mol/L
B.电解后所得溶液中c(H+)=2 mol/L
C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3
D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________。
(2)下列关于CH4和CO2的说法正确的是_______________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”
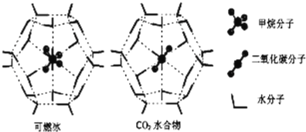
分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_______________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
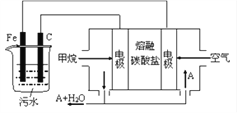
A. 石墨电极上发生氧化反应 B. 通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
C. 通空气的电极反应式为O2+4e-=2O2- D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______。乙醛中碳原子的杂化轨道类型为______,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度______ gcm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 molL-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是
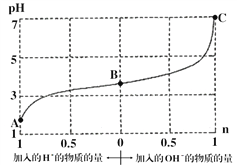
A. A、B、C三点所表示的溶液中水的电离程度依次增大
B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-)
C. 通入HCl, R-的水解程度增大,HR的电离常数减小
D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
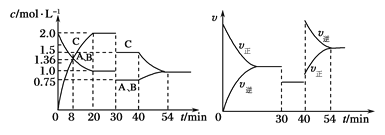
下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com