
| n(OH-) | ||
n(
|
| 0.08mol |
| 0.005mol |
| 16 |
| 1 |
| 1.74g |
| 58g/mol |
| 2.0mol/L×45mL×10-3L?mL-1-0.03mol×2 |
| 3 |
| 3.01g-2.65g |
| 18g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有的分子数为NA |
| B、32gO2在标准状况下所占体积约为22.4L |
| C、标准状况下,18gH2O所占的体积约是22.4L |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 1 | 2 | 3 | 4 |
| n[N2O5(g)]/mol | 1.00 | 0.80 | 0.64 | a | 0.5 |
| n[NO2(g)]/mol | 0.00 | 0.40 | b | 1 | 1 |
| n[X(g)]/mol | 0.00 | 0.10 | 0.18 | 0.25 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
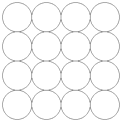 某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax.如图所示为Ax堆积的片层形式,然后第二层就堆积在第一层的空隙上.请根据Ax的堆积形式回答:(简要写出过程)查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐溶液 | NaCl | Na2CO3 | NH4Cl、 | CH3COONa | Na2SO4 |
| PH值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com