
| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 4:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
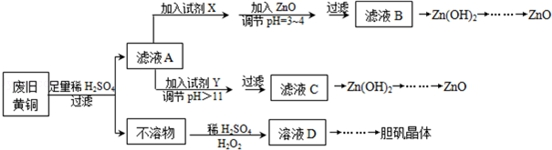
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
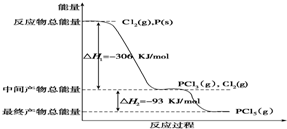
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
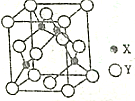 已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:
已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com