
下列各组混合物中,能用分液漏斗进行分离的是()
A. 酒精和水 B. 碘和四氯化碳 C. 水和四氯化碳 D. 汽油和植物油
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
现由C6H12,CH3CHO,CH3COOH组成的混合物,已知O质量分数为a%,则碳的质量分数为( )
|
| A. |
| B. | 1﹣a% | C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论正确的是
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水
B.实验室里需要480 mL 2.0 moI·L-1氢氧化钠溶液,配制溶液时先称量氢氧化钠固38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
C. 25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变
D. K2CO3在酒精灯上灼烧时能直接观察到紫色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 1mol任何气体所含分子数都相同,体积也都约为22.4 L
B. 1molKClO3和1molSO2中,所含氧原子的个数比为3:2
C. 物质的量就是物质的摩尔质量
D. 在非标准状况下,1 mol任何物质的体积都不是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10﹣9m)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是()
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
将下列物质按酸、碱、盐、氧化物分类排列,正确的是()
A. 硫酸、纯碱、生石灰、氧气 B. 醋酸、烧碱、硝酸钾、干冰
C. NaHSO4、乙醇、CaCO3、水 D. 硝酸、熟石灰、苛性钠、甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应中,氧化反应与还原反应在同种元素中进行的是()
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. 2KClO3 2KCl+3O2↑
2KCl+3O2↑
C. 2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D. 2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为: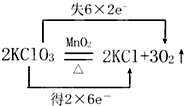 回答下列各题:
回答下列各题:
(1)该反应的基本类型为 .
(2)该反应中被还原的元素名称为 .
(3)式子“失6×2e﹣”中各数字的含义分别是 、 .
(4)从反应后的固体混合物中分离出难溶于水的MnO2操作方法:溶解、过滤、洗涤、干燥
(5)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
A 氧化性 B还原性 C酸性
(6)以上两个反应都用到MnO2,其作用分别是 、 .
(7)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com