
��.���ķ���ϩ�������Ժͻ�ѧ�ȶ����϶��������������ϣ��ųơ�����֮����������������ɻ���������������У��ܷ����ϣ�����Ѫ�ܣ���ѩ�壬��ճ���ȡ���ϳ�·������ͼ��ʾ��

д�����л�ѧ��Ӧ����ʽ��
B��C��_______ _________________
C��D��_____________ _
��ʵ������ȡ��ϩ����ʱ�������¶ȹ����ҺѸ�ٱ�ڣ����������д̼�����ζ������SO2��ijͬѧ�������ͼ��ʾ��ʵ��װ����ȷ֤��Ӧ�ƵõĻ�������к�����ϩ��SO2��

�ɹ�ѡ����Լ��������Ը��������Һ����ϡ���ᡢ��Ũ���ᡢ��Ʒ����Һ����ʯ����Һ����NaOH��Һ��
��1����װ������ʢ�ŵ��Լ��ֱ��ǣ���д��ţ���A_________��B_________��C_________��D_________��
��2��װ��B��������__________________��װ��C��������___________________��
��3����˵����������к�SO2��ʵ��������_________ ______��ȷ֤�������������ϩ��ʵ��������____ __��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����и�����ѧ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��M��N�Ƕ���������Ԫ�أ���ԭ����������������֪X�������������ǵ��Ӳ�����3����X��Mͬ���壬Y��ԭ���ڶ���������Ԫ����ԭ�Ӱ뾶�������˵����ȷ����
A��X��Y�ļ����Ӱ뾶��r��X2������r��Y+��
B��Y2X��Y2X2�����������ӵĸ�������ͬ����ѧ������Ҳ��ȫ��ͬ
C��M��X�γɵĻ������Ӧ��ˮ����һ����ǿ��
D��M����̬�⻯���N����̬�⻯���ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ܱ������н�CO��ˮ�����Ļ������ȵ�800��ʱ��������ƽ�⣺CO(g)��H2O(g) CO2(g)��H2(g)����K��1������2molCO��2mol H2O���ϲ����ȵ�800�棬��CO��ת����Ϊ
CO2(g)��H2(g)����K��1������2molCO��2mol H2O���ϲ����ȵ�800�棬��CO��ת����Ϊ
A��16.7% B��50% C��66.7% D��83.3%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ��10��������ѧ�Ծ��������棩 ���ͣ������
��9�֣����ӡ�ÿ���������桷�ع��˺ӱ�ʡһЩ������ҵ��Ƥ����ϰ��Ƴɹ�ҵ���������۸��㽭����ijЩ��ҩ��ҵ�����ձ��ҩ�ý��ҽ��뻼�߸��С�������ˮ���Ե����ʻ�������ˮ�γɽ��塣�ɹ�ҵ�����ƳɵĽ����������г�����ؽ���Cr���Ӷ�����������˺���
��1����֪Fe(CrO2)2�и�Ԫ����+3�ۣ���������Ԫ���� �ۡ�CrO2����һ��������ӣ���Fe(CrO2)2����__________����ᡱ����������Ρ������������������ˮ��Һ��K2SO4��Һ��ͬ�߱��������� ��
a�������ȶ����ܷ���ó���
b�����߾��ж��������
c����ɢ�����ӿ�ͨ����ֽ
��2����֪CN�����ӡ�SCN�����Ӻ�Cl������������֮���������(CN)2���������(SCN)2��������Cl2Ҳ������֮�����ҳ��³�ѹ��Ϊ���壬������з�Ӧ����ʽ��
��MnO2��HSCN��Ũ��Һ���ȵĻ�ѧ����ʽ��ʽ�� ��
��(CN)2��NaOH��Һ��Ӧ�����ӷ�Ӧ����ʽ�� ��
��3����֪H2O2�Ƕ�Ԫ���ᡢ��д��H2O2��Ca(OH)2��Һ��Ӧ������ʽ�εĻ�ѧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ��10��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��FeI2��FeBr2�Ļ����Һ��ͨ����������������Һ��ijЩ���ӵ����ʵ����仯����ͼ��ʾ�������й�˵������ȷ����
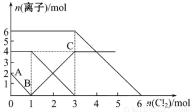
A�����ӵĻ�ԭ��˳��Ϊ��Fe2+��Br����I��
B��ԭ�����Һ��FeBr2�����ʵ���Ϊ4mol
C��ԭ��Һ�У�n(Fe2+)��n(I��)��n(Br��)=2��1��3
D����ͨ��2 mol Cl2ʱ����Һ�з��������ӷ�Ӧ�ɱ�ʾΪ��2Fe2++2Br��+2Cl2��2Fe3++Br2+4Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йص绯ѧԭ����˵���У��������
A������ʵ�����У��绯ѧ��ʴҪ�Ȼ�ѧ��ʴ���صĶ࣬Σ������
B����ͭ�ľ���װ���У�ͨ���ô�ͭ������������ͭ������
C���ȼҵ����Ҫ���е�����ڵ��Ȼ�������ȡ��ҵ����Ҫ�Ļ���ԭ���ռ������
D���ɳ��ĵ�سơ����ε�ء����ڳ��ʱ���ǽ�����ת��ɻ�ѧ�ܣ��ڷŵ�ʱ���ֽ���ѧ��ת���ɵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��ʯ�и�һ��ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
Ϊ��ȥ�����е�CaCl2��MgCl2��FeCl3��Na2SO4 �Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������

��1������ʵ���еڢݲ�������Ҫ�ձ���____________��___________�Ȳ���������
��2���ж�BaCl2�ѹ����ķ����� ��
��3���ڢܲ���������صĻ�ѧ����ʽ�� �� ��
��4�������������pHֵ�ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��A��B�Ļ������1 mol�����ݻ�Ϊ2 L���ܱ������ڣ���һ�������·�����Ӧ��2A(g)+3B(g) C(g)+2D(g)������4min�ﵽƽ�⣬��ʱ�����ڵ�ѹǿ�Ƿ�Ӧǰ��3/5���Ը������Ũ�ȱ仯��ʾ�ķ�Ӧ������ȷ����
C(g)+2D(g)������4min�ﵽƽ�⣬��ʱ�����ڵ�ѹǿ�Ƿ�Ӧǰ��3/5���Ը������Ũ�ȱ仯��ʾ�ķ�Ӧ������ȷ����
A��vA��0.005 mol��(L��min)-1
B��vC��0.025mol��(L��min)-1
C��vB��0.150mol��(L��min)-1
D��vD��0.015mol��(L��min)-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�������
��12�֣������µ��200 mLһ��Ũ�ȵ�NaCl��CuSO4�����Һ��������������������������ʱ��仯�Ĺ�ϵ����ͼ����ʾ����������ѻ���ɱ�״���µ������������ͼ����Ϣ�������м��㣺
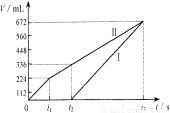
��1��ԭ�����ҺNaCl��CuSO4�����ʵ���Ũ�ȡ�
��2��t2ʱ������Һ��c(H+)��
��3�������t3ʱ������ˮ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com