
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是

A.还原性:I->Fe2+>Br-
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n ( )=6 mol
)=6 mol
B
【解析】
试题分析:A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;根据以上分析可知CD正确,答案选B。
考点:考查氧化还原反应的有关判断与计算


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源:2016届江西省高一(下)期末考试化学试卷(解析版) 题型:推断题
(6分)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
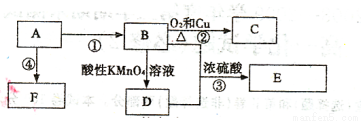
(1)A的结构简式为 。
(2)D分子中的官能团是 ,
(3)写出下列反应的化学方程式
② ④
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高一下学期期末考试化学试卷(解析版) 题型:实验题
(实验班做)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案;甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
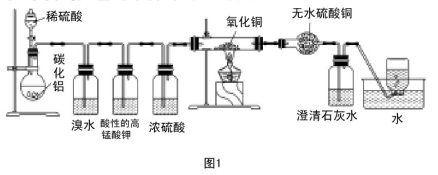
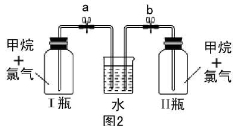
甲实验现象:溴水无颜色变化,澄清石灰水变浑浊,无水硫酸铜变蓝色。乙实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按图2安装好装置,并加紧弹簧夹a和b。
(1)写出碳化铝与硫酸反应的化学方程式 。
(2)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体能否直接排入空气中? (填“能”或“否”)。
(3)下列对实验甲有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出硬质试管里可能发生的化学方程式 ,(按甲烷与氧化铜物质的量之比4:7)
(5)过一段时间,打开图2的a、b弹簧夹,I、II中观察到现象是 。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高一下学期期末考试化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型图正确的是
A. H2O2的电子式: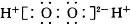 B. CS2的比例模型:
B. CS2的比例模型:
C. 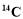 的原子结构示意图:
的原子结构示意图: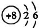 D. CCl4的结构式:
D. CCl4的结构式: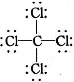
查看答案和解析>>
科目:高中化学 来源:2015界山东省高三第一次9月诊断性考试化学试卷(解析版) 题型:填空题
(10分)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。

(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
查看答案和解析>>
科目:高中化学 来源:2015界山东省高三第一次9月诊断性考试化学试卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g) 2HI(g)△H=+26.48kJ/mol
2HI(g)△H=+26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高三第一次模拟考试化学试卷(解析版) 题型:选择题
下面关于Na2CO3和NaHCO3性质的叙述,正确的是
A.受热时NaHCO3比Na2CO3稳定
B.在水中NaHCO3比Na2CO3溶解性大
C.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高二上学期期中考试化学(理)试卷(解析版) 题型:填空题
(8分)由于反应的情况不同,反应热可以分为多种,如燃烧热和中和热等。
(1)下列各项中的△H表示物质的燃烧热的是 (填字母,下同),表示物质的中和热的是 。
A.2H2(g)+O2(g)=2H2O(g) △H1
B.C(s)+1/2O2(g)=CO (g) △H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3
D.C(s)+O2(g)=CO2 (g) △H4
E.C6H12O6(s) + 6 O2(g) =6 CO2(g)+6 H2O(l) △H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+ H2O(l) △H6
G.2NaOH(aq)+H2SO4 (aq)=Na2SO4 (aq)+ 2H2O(l) △H7
(2)25℃、101kPa时,1gC6H6(l)完全燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,则C6H6的燃烧热为 ,该反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com