
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 严禁露天焚烧农作物秸秆 | |
| B. | 加强植树造林,增大绿化面积 | |
| C. | 大力推行汽车使用天然气或氢气为燃料 | |
| D. | 生产生活中加大煤炭和石油等燃料的使用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 硫酸、盐酸、氢氟酸均为强酸 | D. | 氯水、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液显碱性 | |
| B. | CH3COOH能与氨水发生中和反应 | |
| C. | 室温下,0.1mol/L的CH3COOH溶液的PH为3 | |
| D. | 相同条件下,等浓度的醋酸溶液的导电能力比盐酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时当阳极溶解32 g铜时,转移电子数大于NA个(Cu-64) | |
| B. | 向酸性FeSO4溶液中滴入少量NaClO溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| C. | 向10 mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液20 mL,反应的离子方程式为:2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 浓盐酸与KClO3混合受热制Cl2:6HCl+KClO3═3Cl2↑+3H2O+KCl,1molKClO3反应转移6 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
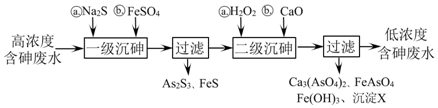
 ;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 230Th和232Th的化学性质相同 | B. | Th元素的相对原子质量是231 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的质量数是232 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com