
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |

分析 矿渣加入足量盐酸,过滤得到沉淀Ⅰ为铜,滤液中含有氯化镁、氯化铝、氯化亚铁,加过量的氢氧化钠铝离子转化为偏铝酸钠,氯化镁、氯化亚铁,反应生成氢氧化镁沉淀、氢氧化铁沉淀,过滤得到滤液Ⅱ为偏铝酸钠溶液,沉淀Ⅱ为氢氧化镁沉淀、氢氧化铁沉淀,加盐酸反应生成氯化镁、氯化铁,加入氢氧化铜控制pH值大于3.7小于9.3,使三价铁离子转化为氢氧化铁沉淀,
(1)沉淀Ⅰ为铜,为良好的金属导体;要使氢氧化铁沉淀,依据表中pH值分析解答;
(2)偏铝酸钠溶液中通入二氧化碳可生成氢氧化铝沉淀,氢氧化铝加热生成氧化铝和水;
(3)氯化铝与足量氢氧化钠反应生成偏铝酸钠和水、氯化钠;
(4)依据氢氧化物开始沉淀和完全沉淀的pH解答;
(5)根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼.
解答 解:矿渣加入足量盐酸,过滤得到沉淀Ⅰ为铜,滤液中含有氯化镁、氯化铝、氯化亚铁,加过量的氢氧化钠铝离子转化为偏铝酸钠,氯化镁、氯化亚铁,反应生成氢氧化镁沉淀、氢氧化铁沉淀,过滤得到滤液Ⅱ为偏铝酸钠溶液,沉淀Ⅱ为氢氧化镁沉淀、氢氧化铁沉淀,加盐酸反应生成氯化镁、氯化铁,加入氢氧化铜控制pH值大于3.7小于9.3,使三价铁离子转化为氢氧化铁沉淀,
(1)沉淀Ⅰ为铜,为良好的金属导体;依据氢氧化物开始沉淀和完全沉淀的pH表,可知要使三价铁离子沉淀,铜离子、镁离子不沉淀,则需满足pH值大于3.7小于9.3;
故答案为:导线等;3.7-9.3;
(2)偏铝酸钠溶液中通入二氧化碳可生成氢氧化铝和碳酸氢钠,化学方程式为NaAlO2+CO2+H2O═NaHCO3+Al(OH)3,2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O;
故答案为:CO2;NaAlO2+CO2+H2O═NaHCO3+Al(OH)3,2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O;
(3)氯化铝与足量氢氧化钠反应生成偏铝酸钠和水、氯化钠,离子方程式::Al3++4OH-═AlO2-+2H2O;
故答案为:Al3++4OH-═AlO2-+2H2O;
(4)滤液Ⅳ中含有镁离子、三价铁离子,加入氢氧化铜调节pH值大于3.7小于9.3,则三价铁离子全部转化为氢氧化铁沉淀,所以滤液Ⅳ中含有离子为:Mg2+,
故答案为:Mg2+;
(5)铝为活泼金属用电解氧化铝法冶炼、铁性质较活泼用热还原法冶炼,反应物为氧化铁与一氧化碳、铜性质较活泼用热还原法冶炼反应物氧化铜与氢气或者一氧化碳、镁性质活泼用电解熔融氯化镁方法冶炼;用到的物质依次为:Al2O3;Fe2O3;CuO;MgCl2;
故选:B;Al2O3;Fe2O3;CuO;MgCl2.
点评 本题为工艺流程题,考查物质的分离、提纯,为高考常见题型,侧重于学生的分析能力和实验能力的熬成,注意把握方程式的书写,金属冶炼的方法,题目综合性较强,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 煤经过气化和液化两种物理变化,可变为清洁能源 | |
| D. | 加热能杀死甲型H1N1流感病毒,主要是加热后使病毒中的蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
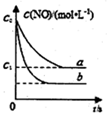 一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T温度下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T温度下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
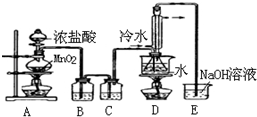 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com