
 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )| A. | 正反应为放热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而减小 | D. | 增大压强,容器内气体的质量变大 |
分析 由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应,增大压强,G的体积分数减小,则平衡向正方向移动即正反应为气体体积减小的方向,说明a>b,据此分析.
解答 解:A、由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应,故A错误;
B、由图象曲线的变化特点可知,增大压强,G的体积分数减小,则平衡向正方向移动即正反应为气体体积减小的方向,说明a>b,故B正确;
C、因为升高温度平衡向正反应方向移动,所以G的转化率随温度升高而增大,故C错误;
D、因为增大压强,G的体积分数减小,则平衡向正方向移动,又L为固体,根据质量守恒,所以容器内气体的质量变大,故D正确;
故选BD.
点评 本题考查化学平衡移动,难度不大,注意分析曲线变化特点,从温度和压强的变化的趋势判断反应的特征.


科目:高中化学 来源: 题型:多选题
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
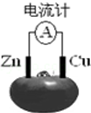
| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol有机物 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 | |
| B. | 有机物分子 与银氨溶液作用后仍具有光学活性 与银氨溶液作用后仍具有光学活性 | |
| C. |  的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 | |
| D. | 2-甲基-1,3-丁二烯在一定温度下和Br2按物质的量之比1:1发生加成反应,所得产物主要有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 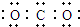 | B. | Cl-的结构示意图 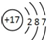 | ||
| C. | HCl的电子式 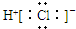 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐增大 | |
| B. | 单质熔、沸点逐渐降低 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 最高价氧化物的水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com