
【题目】一种有机物燃烧后产生CO2,H2O,SO2据此可以断定该化合物中一定含有
A. C.S.O B. C.H.S C. C.H.O.S. D. C.H.O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。下列对头孢羟氨苄的说法中正确的是
 ·H2O
·H2O
A.头孢羟氨苄的化学式为C16H16N3O5S·H2O
B.1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol
C.在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2
D.头孢羟氨苄能在空气中稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钡的活动性处于钾和钠之间,则下述说法不正确的是( )
A. 钡在空气中不能稳定存在 B. 钡可从氯化钠溶液中置换出钠
C. 钡可从冷水中置换出氢而得到H2 D. 在溶液中钡离子不可能氧化金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种物质:①甲烷、②甲苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
A. ③④⑤⑧B. ④⑤⑦C. ④⑤D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1 L的恒容密闭容器中发生如下反应:A(g)+2B2(g)![]() C(g)
C(g)
其中容器Ⅰ中的反应在5 min时达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
A(g) | B2(g) | C(g) | C(g) | ||
Ⅰ | 500 | 0.5 | 1.0 | 0 | 0.4 |
Ⅱ | 500 | a | b | 0.25 | 0.4 |
Ⅲ | 600 | 0.25 | 0.5 | 0.25 | 0.35 |
下列说法不正确的是
A. 容器Ⅰ中的反应在前5 min的平均反应速率v(A)=0.08 mol·L-1·min-1
B. 该反应的正反应为放热反应
C. 容器Ⅱ中起始时a=0.25,b=0.5
D. 若起始时向容器Ⅰ中加入A 0.8 mol、B2 1.6 mol,达到平衡时A的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X; D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族。请回答下列问题:
(1)依次写出A、B、C、D、E五种元素的名称 _____ _____ _____ _____ _____ 。
(2)X的名称为_________,A、C、D构成的化合物中含有的化学键有_____________。
(3)下列各项中,能说明元素C比E非金属性强的事实有____________(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(4)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
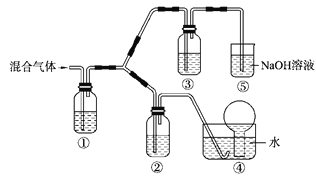
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2 ====== NaBC2+NaBC3+ H2O, NaOH溶液与BC气体不反应。
装置①、②、③中盛放的药品依次是_________、_________、 ___________。
(5)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是___________(填一种气体的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚具有重要用途,请观察如下合成路线:
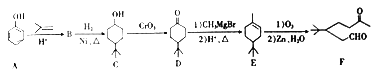
(1)请结合相关信息,写出以苯酚和乙烯为原料制备有机物![]() 的合成路线流程图(无机试剂任用):_________________________________________________。
的合成路线流程图(无机试剂任用):_________________________________________________。
(2)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:___________、___________ (任写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺,白色有光泽片状结晶或白色结晶粉未,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。制备原理如下:
C6H5-NH2+ CH3COOH![]() C6H5-NH-CO-CH3+ H2O
C6H5-NH-CO-CH3+ H2O
熔点:-6.2℃ | 供点:16.6℃ | 熔点:114.3℃ |
沸点:184.4℃ | 沸点:117.9 ℃ | 沸点:304℃ |
相对分子量:93 | 相对分子量:60 | 相对分子量:135 |
微溶于水 | 密度:1.050g·mL-1 | 微溶于冷水,溶于热水 |
易被氧化 | 呈中性或极弱碱性,遇酸或碱性水溶液易分解成 | |
密度:1.0217 g·mL-1 | 苯胺及乙酸 |

实验步骤为:
a.在圆底烧瓶中加入10mL新蒸馏制得的苯胺、15 mL冰醋酸和少许锌粉(约0.2g)和几粒沸石,并连接好装置。
b.用小火加热回流,保持温度在105℃约1小时,当温度下降时表明反应已完成,边搅拌边趁热过滤,然后将反应物倒入盛有250 mL冷水的烧杯中。
c.冷却后抽滤,用冷水洗涤粗产品,将粗产品移至400 mL烧杯中,加入300 mL水并加热使其充分溶解,稍冷,待乙酰苯胺晶体析出,抽滤后压干并称重为12.58 g。
回答下列问题:
(1)A仪器的名称是______________,刺形分馏柱的作用是____________。
(2)加入的锌粉与醋酸反应,化学方程式为____________;其目的是__________________。
(3)从粗产品到晶体,采用的实验方法是____________(填字母)。
A.过滤 B.结晶 C.重结晶 D.抽滤
(4)本实验提高产率的主要措施有____________、____________。
(5)实际产率是____________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com