
分析 (1)①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,以此判断;
②如果溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低;
(3)根据配制一定物质的量浓度的溶液使用的仪器进行解答;
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小;
(5)根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量及浓度.
解答 解:(1)①中和滴定有检漏(E)、洗涤(C)、润洗(C)、装液(D)、调零(D)、取待测液(B)加指示剂(A)、滴定(G、F)等操作,或检漏(E)、洗涤(C)、润洗(C)、取待测液(B)、加指示剂(A)、装液(D)、调零(D)、滴定(G、F)等操作,
故答案为:ECDBAGF或ECBADGF;
②用标准0.1400mol•L-1NaOH溶液滴定未知浓度硫酸,用酚酞作指示剂,所以终点时现象是当溶液由无色变为浅红色(或粉红色),且在半分钟内不褪色为滴定终点,
故答案为:无色变为浅红色(或粉红色)且半分钟不褪去;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大,
故答案为:偏大;
(3)配制0.1400mol•L-1NaOH标准溶液100mL的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管、100mL容量瓶,必须使用到的玻璃仪器是为:100mL容量瓶、烧杯、玻璃棒、胶头滴管,
故答案为:100mL容量瓶、烧杯、玻璃棒、胶头滴管;
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小,
故答案为:偏小;
(5)滴定时消耗的氢氧化钠的物质的量为n(NaOH)=cV=0.14mol•L-1×0.01500L
根据反应:2NaOH+H2SO4=Na2SO4+2H2O,则:n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.14mol•L-1×0.01500L,
所以100mL硫酸中物质的量为$\frac{1}{2}$×0.14mol•L-1×0.01500L×$\frac{100mL}{25mL}$=0.0042mol,
则待测硫酸溶液的物质的量浓度c=$\frac{n}{v}$=$\frac{0.0042mol}{0.1L}$=0.0420mol/L,
故答案为:0.0420mol/L.
点评 本题考查了酸碱中和滴定,涉及了实验步骤、滴定方法、误差分析等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意掌握酸碱中和滴定的实验步骤和注意事项误差分析的方法.


科目:高中化学 来源: 题型:多选题
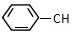 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )| A. | 分子式为C9H10 | B. | 该有机物的一氯代物有5种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 所有碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 寺院内铜佛像用导线与直流电源的正极连接可以防锈 | |
| B. | 家厨内铁锅洗净后未擦干易生锈主要是发生了化学腐蚀 | |
| C. | 红葡萄酒密封贮存越久越香可能是因为缓慢生成了酯类物质 | |
| D. | 液氯泄漏时,可用肥皂水浸湿的毛巾捂鼻俯卧于低处等待救援 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
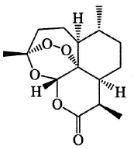 中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )
中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )| A. | 提取过程中为防止破坏青蒿素结构,应避免高温,故采用低沸点溶剂乙醚进行萃取 | |
| B. | 可使用质谱仪测出这个分子的相对分子质量,也可用紫外光谱确定这个分子的环状结构 | |
| C. | 青蒿素是脂溶性的,既可看作是醚类也可看作是酯类,既有氧化性又有还原性 | |
| D. | 元素分析仪可以确定青蒿素中是否含有C、H、O等元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com