
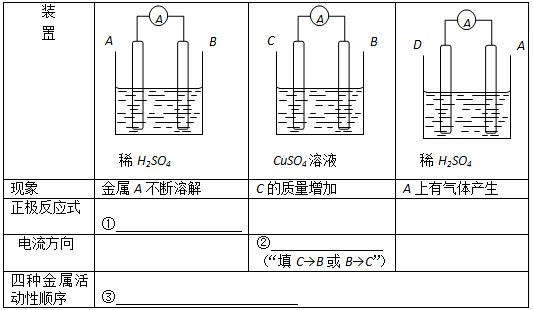


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
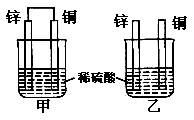
| A.两烧杯中铜片表面均有气泡产生 |
| B.甲烧杯中的电流与阳离子流向均为Zn→Cu |
| C.两烧杯中溶液的pH均增大 |
| D.两烧杯在相同时间内转移电子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放电过程中[OH-]不变 | B.Zn为负极而Ag2O为正极 |
| C.电解质溶液呈碱性 | D.电子从Ag2O流出经用电器流入Zn极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.充电电池充电时,发生电解池反应;放电时,发生原电池反应 |
| B.电镀时,应将镀层金属与电源正极相连 |
| C.电解饱和NaCl溶液时,阳极上放出黄绿色气体的同时还产生大量的氢氧化钠 |
| D.利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
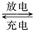 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 电极材料 | Cu、Zn | Cu、Ag | Cu、C | Fe、Zn |
| 电解液 | FeCl3 | Fe2(SO4)3 | Fe(NO3)2 | CuSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
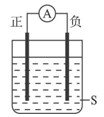
| A.正极Cu,负极Al,S为浓HNO3 |
| B.正极Ag,负极Fe,S为CuSO4 |
| C.正极Al,负极Cu,S为浓HNO3 |
| D.正极Zn,负极Cu,S为CuSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2·8H2O与NH4Cl的反应 | B.铝片与浓硫酸的反应 |
| C.甲烷与氧气的反应 | D.石灰石的分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com