


分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径①是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;途径②是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体,
Ⅰ、(1)NaClO是一种强氧化剂;
(2)通常可以增加空气的流通量、固体粉碎或逆流焙烧等措施来提高焙烧效率;
(3)途径①用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,同时有SO42-生成,据此可写出离子反应方程式;
(4)使用的次数较多后,母液中杂质的浓度增大,影响产品纯度;
(5)根据钼酸呗和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,在再计算出SO42-的去除率;
II、(1)根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因;
(2)根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处,即钼酸钠的浓度150mg•L-1,据此计算出钼酸钠的物质的量浓度.
解答 解:I.(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是B,
故答案为:B;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧,
故答案为:充分粉碎矿石或逆流焙烧;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为:MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)由于母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度,所以重结晶达到一定次数后必须净化处理,
故答案为:母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=$\frac{4.0×1{0}^{-8}}{0.40}$molL=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-7}}$mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-$\frac{1.1×1{0}^{-3}}{0.04}$×100%=1-2.75%≈97.3%;
故答案为:97.3%;
II.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度,硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:$\frac{150×1{0}^{-3}g}{206g/mol}$≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1;
故答案为:7.28×l0-4mol•L-1.
点评 本题通过制备钼酸钠晶体考查制备方案的设计,题目难度中等,注意分析题中图示是解题关键,最后一问有一定的难度,容易出错,需要合理应用题中数据,试题培养了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大,X原子核内只有1个质子;Y的原子最外层电子数是其电子层数的2倍,Y与G同主族;Z的一种单质能吸附对人体有害的紫外线;M是地壳中含量最高的金属元素.
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大,X原子核内只有1个质子;Y的原子最外层电子数是其电子层数的2倍,Y与G同主族;Z的一种单质能吸附对人体有害的紫外线;M是地壳中含量最高的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 已知时25℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| C. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c (Mg2+)=1.8×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数ω(Na2CO3),称取此混合物mg,溶于水中,配成溶液.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.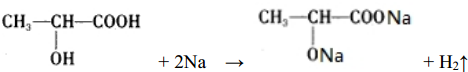 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 以上R、R′、R″代表烃、烷基或芳基等)
以上R、R′、R″代表烃、烷基或芳基等)
 ,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F).
,则与F具有相同官能团的同分异构体共5种(考虑顺反异构,不包含F). ,反应类型为消去反应.
,反应类型为消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com