
分析 根据Fe原子的核外电子排布式确定未成对电子数,失去2个电子变为亚铁离子;将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,依据化学方程式的书写原则,原子守恒,氧化还原反应的化合价升降总数相同进行相等.
解答 解:26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,基态Fe原子核外处在能量最高的能级为3d,排布了6个电子,有6种不同的运动状态,可知在3d上存在4个未成对电子,失去2个电子变为亚铁离子,亚铁离子的电子排布式为1s22s22p63s23p63d6,故最高能层的电子排布式为:3s23p63d6;
将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,配平得到化学方程式为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O;
故答案为:3s23p63d6;Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
点评 本题考查原子核外电子排布规律的运用和化学方程式的书写,难度不大,注意氧化还原反应的配平.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
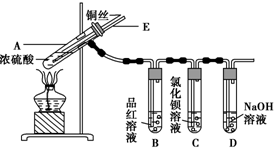
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2=CHCH3) | ||
| C. | 石墨和C60 | D. | 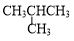 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
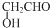
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com