
分析 (1)锌锰电池失电子的一极为负极;碱性条件下,Zn失电子生成Zn(OH)2;
(2)①根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极、失电子化合价升高的金属为负极;
②放电时,消耗硫酸,电解质溶液中阳离子向正极移动、阴离子向负极移动,电流从正极流向负极;
(3)可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-═Li+,正极发生还原反应,电极方程式为:2SOCl2+4e-═4Cl-+S+SO2,据此分析.
解答 解:(1)锌锰电池失电子的一极为负极,则Zn失电子为负极;碱性条件下,Zn失电子生成Zn(OH)2,负极的电极方程式为:Zn-2e-+2OH-═Zn(OH)2;
故答案为:Zn;Zn-2e-+2OH-═Zn(OH)2;
(2)①根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极,则为正极;失电子化合价升高的金属为负极,则Pb为负极,负极的电极方程式为Pb-2e-+SO42-═PbSO4,
故答案为:PbO2;Pb-2e-+SO42-═PbSO4;
②放电时,正负极上都消耗硫酸,同时生成硫酸铅沉淀,溶液的密度减小,电解质溶液中阳离子向正极移动、阴离子向负极移动,即阴离子向Pb极移动;电流从正极流向负极,即从PbO2极向Pb极移动;
故答案为:减小; Pb; PbO2;Pb;
(3)①电池的负极材料为锂,其电极反应式为:Li-e-═Li+,故答案为:锂;Li-e-═Li+;
②Li是活泼金属,能与水氧气等发生反应,所以组装该电池必须在无水、无氧的条件下进行,故答案为:锂与水、氧气发生化学反应.
点评 本题考查了原电池原理,明确正负极上发生反应及元素化合价变化即可解答,知道电流方向、电解质溶液中阴阳离子移动方向等知识点,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 原子半径:B>A>C>D | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
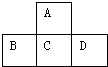 图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:AO,BP,CS,DCl.
图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:AO,BP,CS,DCl.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃类分子中的碳原子与其他原子间通过非极性键结合 | |
| B. | 烷烃是饱和的链烃,分子中碳原子不可能在同一平面上 | |
| C. | 甲烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| D. | 烷烃的沸点随碳原子数增加而逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol H2SO4 | B. | 0.4 mol H2O2 | C. | 0.6mol HNO3 | D. | 0.8 mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1mol/L的KOH溶液和0.1mol/L的醋酸溶液中,由水电离的OH-浓度 | |
| B. | 常温常压下,0.1mol/L的KOH溶液和0.1mol/L的盐酸溶液中,由水电离的OH-浓度 | |
| C. | 25℃,100mL0.1mol/L醋酸溶液与10 mL 1 mol/L醋酸溶液中的k(HAc) | |
| D. | 100mL0.1mol/L醋酸溶液与10 mL 1 mol/L醋酸溶液中H+的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大 | |
| B. | 25℃时,0.1mol•L-1的HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| C. | 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 25℃时,沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+Ca(OH)2=CaCO3↓+H2O | B. | SO3+H2O=H2SO4 | ||
| C. | 2KMnO4=K2MnO4+MnO2+O2↑ | D. | 2NaHCO3=Na2CO3+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com