
分析 (1)根据n=$\frac{m}{M}$计算1.43gNa2CO3•10H2O的物质的量,n(Na2CO3)=n(Na2CO3•10H2O),根据c=$\frac{n}{V}$计算所得溶液中Na2CO3的物质的量浓度;
(2)稀释碳酸钠的浓度为0.04mol/L,根据稀释定律计算稀释后溶液的体积,进而计算加入蒸馏水的体积.
解答 解:(1)1.43gNa2CO3•10H2O的物质的量=$\frac{1.43g}{286g/mol}$=0.005mol,n(Na2CO3)=n(Na2CO3•10H2O)=0.005mol,配成100mL溶液,Na2CO3物质的量浓度为$\frac{0.005mol}{0.1L}$=0.05mol/L,
答:Na2CO3物质的量浓度为0.05mol/L;
(2)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,令稀释后溶液的体积为VmL,根据稀释定律,
0.05mol/L×20mL=0.04mol/L×V mL,
解得V=25,
故加入蒸馏水的体积为25mL-20mL=5mL,
答:需要加入水的体积为5mL.
点评 本题考查物质的量浓度有关计算,比较基础,注意对物质的量浓度定义式的理解与灵活应用,侧重于考查学生的分析能力和计算能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子、氯离子、氯气均为黄绿色,且氯离子比氯原子结构稳定 | |
| B. | 氯原子易得电子,所以Cl2在化学反应中氯元素化合价只会降低 | |
| C. | 氯原子、氯离子、氯气分子中原子的最外层均达到8电子结构 | |
| D. | 氯元素在自然界中不存在游离态,只以化合态形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
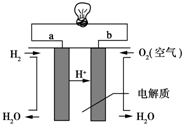
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
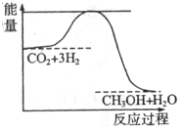 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
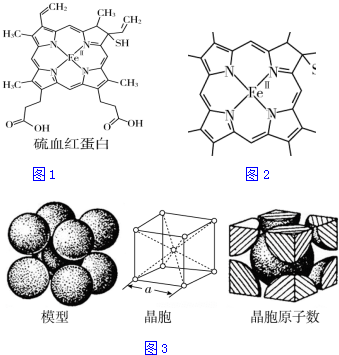
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C为短周期元素,在周期表中所处的位置如图所示.
A、B、C为短周期元素,在周期表中所处的位置如图所示.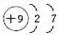 ,C的单质与水反应的化学方程式为2F2+2H2O=4HF+O2;
,C的单质与水反应的化学方程式为2F2+2H2O=4HF+O2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2->F->Na+>Mg2+ | B. | Na>Mg>Cl>Ar | C. | I>Br>F>Cl | D. | Na>Na+>S2->S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com