
����Ŀ�����ܸ߷���P�ĺϳ�·�����£�
��1��A�ķ���ʽ��C7H8 �� ��ṹ��ʽ�� ��
��2���Լ�a�� ��
��3����Ӧ�۵Ļ�ѧ����ʽ�� ��
��4��E�ķ���ʽ��C6H10O2 �� E�к��еĹ����ţ� ��
��5����Ӧ�ܵķ�Ӧ������ ��
��6����Ӧ�ݵĻ�ѧ����ʽ�� ��
��7����֪��2CH3CHO 
����ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л�����ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
���𰸡�
��1��![]()
��2��Ũ�����Ũ����
��3��![]() +NaOH
+NaOH ![]()
![]() +NaCl
+NaCl
��4��̼̼˫��������
��5���Ӿ۷�Ӧ
��6��![]() +nH2O
+nH2O ![]()
![]() +n CH3CH2OH
+n CH3CH2OH
��7��
CH2=CH2![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3CHO
CH3CHO ![]()
![]()
![]()
![]()
![]()
![]()
![]() CH3CH=CHCOOH
CH3CH=CHCOOH ![]() CH3CH=CHCOOCH2CH3��
CH3CH=CHCOOCH2CH3��
��������
��1�� ![]() ����2��Ũ�����Ũ�����3��
����2��Ũ�����Ũ�����3��![]() +NaOH
+NaOH ![]()
![]() +NaCl����4��̼̼˫����������
+NaCl����4��̼̼˫����������
��5���Ӿ۷�Ӧ����6�� ![]() +nH2O
+nH2O ![]()
![]() +n CH3CH2OH��
+n CH3CH2OH��
��7��CH2=CH2![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3CHO
CH3CHO ![]()
![]()
![]()
![]()
![]()
![]()
![]() CH3CH=CHCOOH
CH3CH=CHCOOH ![]() CH3CH=CHCOOCH2CH3 �� ���Դ��ǣ�CH2=CH2
CH3CH=CHCOOCH2CH3 �� ���Դ��ǣ�CH2=CH2![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3CHO
CH3CHO ![]()
![]()
![]()
![]()
![]()
![]()
![]() CH3CH=CHCOOH
CH3CH=CHCOOH ![]() CH3CH=CHCOOCH2CH3 ��
CH3CH=CHCOOCH2CH3 ��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ��
��1�������������͡�к���һ����ӣ���ˮ�к����������������ᣮ�����鷢�֣������������κӴ����л�����FeS2 �� ��Ϊ+2�ۣ�����ˮ�����������£������˷�Ӧ��2FeS2+7O2+2H2O�T2FeSO4+2H2SO4 �� ��Ӧ��FeS2���������������� �� ����1mol FeS2��ȫ��Ӧʱ��ת�Ƶĵ�����mol��
��2��ijͬѧ������ϡ���������п��Ӧ�Ʊ���״���µ�����224ml��Ϊ��ֹ�������������˷ѣ�ʵ����Ӧ��Ҫ����mol��
��3��ʵ��������һƿϡ������ͼA��ʾ��BΪ��ƿ��������Aƿ�е�ϡ��������Bƿ�ϱ�ǩ��ʾϡ����240ml����Ҫ���IJ�����������Ͳ���ձ�������������ͷ�ιܺ� �� ����Aƿ��ϡ�������� �� ��������Һʱ��ʵ������������������������������Һ�����ʵ���Ũ��ƫ�͵IJ����ǣ�����ţ� �� 
��ϡ�͵�����ת�Ƶ�����ƿ�к�δϴ���ձ�
�ڳ��Ƚ���Һע������ƿ�в�����
��ҡ�Ⱥ���Һ����ڿ̶��������ּ�ˮ
������ƿ��ԭ����������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش��������⣺
һ���¶��£���һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g��CH3OH��g����H��0
��1���������β���˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.ÿ����1mol CO��ͬʱ����2molH2
B.������������ʵ�������
C.����CH3OH������������CO���������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��B��C�����ƽ�ⳣ��KB��KC�Ĵ�С��ϵΪ �� 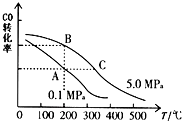
��3��ij�¶��£���2.0mol CO��6.0molH2����2L���ܱ������У��ﵽƽ��ʱ���c��CO��=0.25mol/L��CO��ת����= �� ���¶��µ�ƽ�ⳣ��K=��������λ��Ч���֣���
��4���¶�650���������ȼ�ϵ�أ��ã�CO��H2������Ӧ�������CO2�Ļ������Ϊ������Ӧ������缫����Li2CO3��Na2CO3�����������ʣ��õ�ص�������ӦʽΪ ��
��5����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��ijʵ��С�����������ʵ����̽��Ӱ�컯ѧ��Ӧ���ʵ����أ� ʵ��I���ڼס��ҡ�����ֻ��ͬ���Թ��зֱ����5mL����������Ϊ5%�Ĺ���������Һ������������ϴ�Ӽ����ٷֱ�ŵ���ͼ��ʾ���ձ���ˮԡ���ȣ�ʵ�鷢�֣���֧�Թ��в������ݵ����ʲ�ͬ����ϴ�Ӽ��������Ϊ���ݵ����ã�
ʵ����ڼס��ҡ�����ֻ��ͬ���Թ��зֱ����5mL����������Ϊ5%�Ĺ���������Һ������������ϴ�Ӽ����ڼ��Թ��м���MnO2�����������Թ��м�������FeCl3 �� �ڱ��м����������ʵļ����࣮�۲쵽���Թ��в������ݵ����������������Թ��в������ݵ�������죮
ʵ����ڼס��ҡ�����ֻ��ͬ���Թ��зֱ����5mL���������ֱ�Ϊ5%��10%��15%�Ĺ���������Һ������������ϴ�Ӽ����ٷֱ�μ�����ŨFeCl3��Һ���۲첢��¼ʵ������
ʵ������ڼס��ҡ�����ֻ��ͬ���Թ��зֱ�������������࣬�ٷֱ�ŵ���ͼ��ʾ���ձ���ˮԡ����2���ӣ��ٷֱ�����֧�Թ��м���5mL����������Ϊ5%�Ĺ���������Һ������ϴ�Ӽ����۲쵽���в�����������������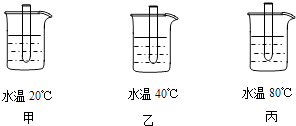
���������ĸ�ʵ�飬�ش��������⣺
��ʵ��I��ʵ�������� ��
��ʵ����ʵ��Ŀ���� ��
��ʵ����ʵ��Ŀ�������������������������Թܣ���ס����ҡ���������
��ʵ����б���������������������ʵ�������ԭ������� ��
��2����һ���¶��£���0.20 mol �������������������1L�Ĺ̶����ܱ�������ÿ��һ��ʱ��Ը������ڵ����ʽ���һ�η������õ��������ݣ�
ʱ�� ��s�� | 0 | 20 | 40 | 60 | 80 | 100 |
C��N2O4�� | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
C��NO2�� | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
���ݱ����ṩ���ݣ���ش����и�С�⣺
��C1C2���������=����
����0��20S��������������ƽ����Ӧ�ٶ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� �� ��֪��Cu+![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 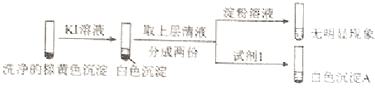
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ��
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������������ַ�����ȡ���������ú�HCl146g��Ũ������������MnO2��Ӧ������87gMnO2������Ũ����ķ�Ӧ��������Cl2
A. �ٱȢڶ� B. �ڱȢٶ� C. һ���� D. ���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ϡ��Һ���Ӧ��������ǰ�ߵ�����ߣ����Ǻ��ߵ���ǰ�ߣ���Ӧ������ͬ���ǣ� ��
A.NaHSO4��Ba��OH�� 2
B.AlCl3��NaOH
C.NaAlO2��H2SO4
D.Na2CO3��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ�����������ƿ���ֱ�װ���״���µĸ��ﰱ�������ж���֮һ����������Ȼ��⡢���������������������Ϊ4��1���Ļ�����壻Ȼ��ֱ����ܽ���ˮ����Ȫʵ�飮ʵ�������������ƿ��������Һ�����ʵ���Ũ��֮��Ϊ�� ��
A.2��1��2
B.5��5��4
C.1��1��1
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2��g��+ ![]() O2��g���TH2O��l����H=��285.8kJmol��1
O2��g���TH2O��l����H=��285.8kJmol��1
��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJmol��1
O2��g���TH2O��g����H=��241.8kJmol��1
��C��s��+ ![]() O2��g���TCO��g����H=��110.5kJmol��1
O2��g���TCO��g����H=��110.5kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ���� ��
��2��H2��ȼ����Ϊ��C��ȼ����Ϊ ��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ ��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ����ȼ���ȡ�HΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com