
50mL物质量浓度为18mol/L的硫酸中加入足量铜片并加热,充分反应。下列有关说法中正确的是
A、有0.09mol的硫酸被还原
B、有0.045mol的硫酸被还原
C、充分反应后体系无硫酸剩余
D、消耗的铜的质量一定少于2.88g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 100(b-a) |
| a |
| 100(b-a) |
| a |
| 11200 |
| 57 |
| 11200 |
| 57 |
| 40a |
| 57 |
| 40a |
| 57 |
查看答案和解析>>
科目:高中化学 来源: 题型:
|
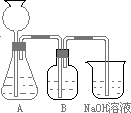
![]() 回答下列问题:
回答下列问题:
![]() (1)在(A)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
(1)在(A)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
![]() (2)在(B)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
(2)在(B)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
![]() (3)原NaOH溶液的物质的量浓度为 。
(3)原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com