
【题目】下列说法正确的是( )
A.H2(g)+I2(g)![]() 2HI(g),平衡后,减压平衡不移动,气体颜色不变
2HI(g),平衡后,减压平衡不移动,气体颜色不变
B.H2(g)+I2(g)![]() 2HI(g),平衡后,加压平衡不移动,气体颜色不变
2HI(g),平衡后,加压平衡不移动,气体颜色不变
C.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
D.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
【答案】D
【解析】
A.反应H2(g)+I2(g)![]() 2HI(g)为气体体积不变的可逆反应,平衡后,减压平衡不移动,但体积增大,浓度减小,气体颜色变浅,选项A错误;
2HI(g)为气体体积不变的可逆反应,平衡后,减压平衡不移动,但体积增大,浓度减小,气体颜色变浅,选项A错误;
B. 反应H2(g)+I2(g)![]() 2HI(g)为气体体积不变的可逆反应,平衡后,加压平衡不移动,但体积减小,浓度增大,气体颜色变深,选项B错误;
2HI(g)为气体体积不变的可逆反应,平衡后,加压平衡不移动,但体积减小,浓度增大,气体颜色变深,选项B错误;
C. 反应2NO2(g)![]() N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项C错误;
N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项C错误;
D. 反应2NO2(g)![]() N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项D正确。
N2O4(g)为气体体积缩小的可逆反应,平衡后,加压平衡正向移动,但容器体积缩小,反应物浓度均增大气体颜色先变深后变浅,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子。请回答下列问题:
(1)B原子最高能级有___个单电子。D原子的价电子排布图为___。
(2)B与C形成的四原子阴离子,其中心原子的杂化方式为__。
(3)C3分子的立体构型为__;与其互为等电子体的分子有__,离子有__。
(4)A、B、C、D四种元素简单氢化物沸点由高到低的顺序是___。(用化学式表示)
(5)F在元素周期表中位于__区,F的晶体中原子的堆积方式是图中的__(填写“甲、乙或丙”),其配位数为__。

(6)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式___。
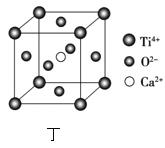
(7)CaTiO3的晶胞为立方晶胞,结构如图丁所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)晶体的密度为ρg/cm3,Ca2+位于O2-构成的正八面体的体心位置,则该正八面体的边长为___nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa,请回答下列问题:
(1)上述几种电解质中属于弱电解质的是______________
(2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) =_____________________
(3)写出CH3COOH的电离方程式_______________________
(4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m ___________n (填“大于、等于或小于”)
(5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加_______mL。(体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0 mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
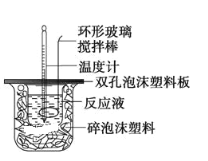
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热___(填“偏大”“偏小”或“不变”)。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),混合后溶液质量为m,反应放出的热量Q=cm△t,则该反应生成水的物质的量为____,中和热为ΔH=____。
(3)若用等浓度的盐酸与NH3·H2O溶液反应,则测得的中和热会___(填“偏大”“偏小”或“不变”),其原因是____。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热____(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是 ( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe3+、Mg2+、NO![]() 、Cl-
、Cl-
C.某无色的溶液:K+、Ba2+、Cl-、MnO4-
D.碳酸氢钠溶液:K+、SO42-、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图:

下列说法不正确的是( )
A.易蒙停的分子式为C29H34Cl2N2O3
B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色
C.1mol易蒙停只能与1molNaOH发生反应
D.1mol易蒙停最多能与3mol溴水发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com