
分析 (1)由离子交换关系,氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,据此计算0.54g FeClx中氯离子物质的量计算x值;
(2)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;氯化亚铁用铁和稀酸反应生成,氯化铁可以直接用铁和氯气反应得到;
(3)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,同时生成氯化钾与水,配平书写离子方程式.
解答 解:(1)n(Cl-)=n(H+)=n(OH-)=0.0250L×0.40 mol•L-1=0.010 mol,则$\frac{0.54g}{(56+35.5x)g/mol}$•x=0.010 mol,解得x=3,故答案为:3;
(2)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=$\frac{1}{1+9}$×100%=10%;
在实验室中,FeCl2可用铁粉和盐酸反应得到,FeCl3可用铁粉和氯气反应生成,
故答案为:10%;盐酸;氯气;
(3)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,同时生成氯化钾与水,反应的离子方程式为2Fe3++3ClO-+10 OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查滴定计算、混合物计算、离子方程式等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应焓变是指1 g物质参加反应时的能量变化 | |
| B. | 当反应放热时,△H>0,反应吸热时,△H<0 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H为“-” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,由水电离出的c(H+)=l0-14mo1•L-1的溶液中:CO32-、SO42-、Na+、K+ | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、CN- | |
| C. | pH为1的溶液:Ca2+、Na+、Mg2+、NO3- | |
| D. | 与铝反应放出氢气的溶液:Fe2+、SO42-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 反应或现象 | 结论 |
| 取少量除尽Cu2+后的溶液于试管中,加入①溶液,振荡 | 显性② | 存在Fe3+ |
| 取少量除尽Cu2+后的溶液于试管中,加入K3[Fe(CN)6]溶液,振荡 | 离子方程式③ | 存在Fe2+ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol任何物质的体积都约为22.4 L | |
| B. | 1mol任何气体所含分子数都相等,体积也都约为22.4L | |
| C. | 相同状况下,1L CO一定比1L O2的质量小 | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含酚酞的氢氧化钠溶液 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.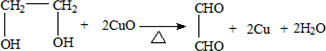 .
. .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com