
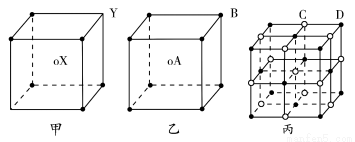
现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知,甲晶体中X与Y的个数比是________,乙中A与B的个数比是________,丙晶胞中有________个C离子,有________个D离子。
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3章物质聚集状态物质性质练习卷(解析版) 题型:选择题
下列对化学知识概括合理的是( )。
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.同素异形体之间的转化都是物理变化
C.原子晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:填空题
在形成氨气分子时,氮原子中的原子轨道发生sp3杂化生成4个________________,生成的4个杂化轨道中,只有________________个含有未成对电子,所以只能与________________个氢原子形成共价键,又因为4个sp3杂化轨道有________________,所以氨气分子中的键角与甲烷不同。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:选择题
下表是某些原子晶体的熔点和硬度
原子晶体 | 金刚石 | 氮化硼 | 碳化硅 | 石英 | 硅 | 锗 |
熔点/℃ | 3 900 | 3 000 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 9.5 | 7 | 6.5 | 6.0 |
分析表中的数据,判断下列叙述正确的是( )。
①构成原子晶体的原子种类越多,晶体的熔点越高
②构成原子晶体的原子间的共价键键能越大,晶体的熔点越高
③构成原子晶体的原子的半径越大,晶体的硬度越大
④构成原子晶体的原子的半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )。
物质 | ①NaF | ②NaI | ③MgO |
离子电荷数 | 1 | 1 | 2 |
离子间距离/10-10 m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.1认识晶体练习卷(解析版) 题型:选择题
有关A1型密堆积与A3型密堆积的说法中正确的是( )。
A.A1型密堆积是最密堆积,A3型密堆积不是最密堆积
B.两者都是最密堆积,其中A3型密堆积是一、三、五……各层球心重合,二、四、六……各层球心重合;A1型密堆积是四、五、六各层球心分别和一、二、三各层球心重合
C.原子晶体一般都采用A1型密堆积或A3型密堆积
D.只有金属晶体才可能采用A1型密堆积或A3型密堆积
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:选择题
已知H2、O2、Cl2、N2分子中共价键的键能依次为436 kJ·mol-1、497 kJ·mol-1、243 kJ·mol-1、946 kJ·mol-1,
(1)下列叙述正确的是 ( )。
A.N—N键键能为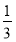 ×946=315.3kJ·mol-1
×946=315.3kJ·mol-1
B.氮分子中共价键的键长比氢分子中共价键的键长短
C.氧分子中氧原子是以共价单键结合的
D.氮分子比氯分子稳定
(2)计算反应3Cl2+2NH3=N2+6HCl(EN-H=391 kJ·mol-1,EH-Cl=432 kJ·mol-1)的反应热。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:填空题
已知86Rn(氡)基态原子的电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6,88Ra基态原子的电子排布式可简化为[Rn]7s2。114号元素是化学家和物理学家很感兴趣的尚未发现的元素。
(1)用简化的形式写出114号元素基态原子的电子排布式: ______________
________________________________________________________________。
(2)根据原子核外电子排布的特征,判断114号元素在周期表中的第________周期________族。
(3)根据114号元素在周期表中的位置判断,它最不应具有的性质是________。
第一电离能大于88Ra
②鲍林电负性大于3.0
③最高化合价为+4价,也可有+2价
④最高价氧化物的对应水化物显碱性
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6专题综合检测练习卷(解析版) 题型:选择题
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是( )。
A.利用太阳能制氢
B.关停小火电企业
C.举行“地球一小时”熄灯活动
D.推广使用煤液化技术
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com