
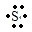
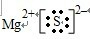
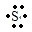
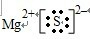
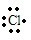
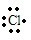
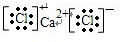
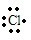
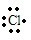
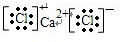


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
(13分)按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是 _______________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
查看答案和解析>>
科目:高中化学 来源:2010—2011学年辽宁省大连协作体高一4月月考化学试卷 题型:填空题
(13分)按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是 _______________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省大连协作体高一4月月考化学试卷 题型:填空题
(13分)按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是 _______________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是 _______________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是 _______________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com